神経遮断薬または抗精神病薬
記事の医療専門家
最後に見直したもの: 04.07.2025
定型抗精神病薬の使用適応
現在、精神薬物療法の分野における権威ある研究者らの推奨によれば、伝統的な神経遮断薬を処方する主な適応症は次のとおりです。
- 重度の精神病症状によって引き起こされる精神運動興奮および行動障害の緩和。これらの症例では、抗精神病薬の経口または非経口投与剤の使用が適応となります。これには、全般的な作用(クロプロマジン、レボメプロマジン、チオプロペラジン、ズクロペンチキソール)と、幻覚・妄想性障害への作用という形での選択的な作用(ハロペリドール、トリフルオペラジン)の両方が含まれます。
- 再発予防療法。この目的で、特に服薬コンプライアンスが低い患者には、デポ剤(ハロペリドールデカノエート、フルペンチキソールの持続型)が処方されます。また、急性精神病の緩和に高用量が用いられる薬剤(フルペンチキソール、ズクロペンチキソール)の中から、脱抑制(抗抑制)効果を得るために少量または中用量の薬剤が処方されます。このタイプの治療では、いわゆる少量神経遮断薬(チオリダジン、クロルプロチキセン、スルピリド)の処方も推奨されます。これらの向精神作用は、うつ病および不眠症の症状に作用することです。
- 急性精神病状態の治療における非定型抗精神病薬に対する治療抵抗性の克服。この目的のために、全般的抗精神病作用(クロルプロマジン、レボメプロマジンなど)および選択的抗精神病作用(ハロペリドール)を有する従来の抗精神病薬の非経口剤が通常使用されます。
これらの薬剤は様々な副作用を引き起こしますが、その性質は各薬剤の薬理学的プロファイルの特性によって異なります。コリン遮断作用が強い抗精神病薬は、調節障害、便秘、口渇、尿閉を引き起こす可能性が高くなります。鎮静作用は抗ヒスタミン作用が強い抗精神病薬に多く見られ、起立性低血圧はα1アドレナリン受容体を遮断する薬剤に多く見られます。典型的な神経遮断薬によるコリン作動性、ノルアドレナリン作動性、ドーパミン作動性の伝達阻害は、無月経または月経困難症、無オルガスムス症、乳汁漏出、乳腺の腫れや痛み、勃起力の低下など、性機能に関する様々な障害を引き起こす可能性があります。性機能における副作用は、主にこれらの薬剤のコリン遮断作用および副腎皮質遮断作用、そしてドーパミン代謝の阻害によるプロラクチン分泌の増加に関連しています。典型的な神経遮断薬の最も深刻な副作用は運動機能障害です。これは患者が服薬を中止する最も一般的な理由です。運動機能への影響に関連する治療の3つの主な副作用は、早期錐体外路症候群、遅発性ジスキネジア、および神経筋麻痺です。
錐体外路症候群は、基底核のD2受容体の遮断に関連していると考えられています。これらの症候群には、ジストニア、神経遮断薬によるパーキンソン症候群、アカシジアなどが含まれます。急性ジストニア反応(早期ジスキネジア)の症状としては、突然の過運動、眼球運動発作、顔面および体幹の筋肉の収縮、後弓反張などが挙げられます。これらの障害は用量依存性があり、ハロペリドールやフルフェナジンなどの強力な神経遮断薬を2~5日間投与した後に発症することがよくあります。早期ジスキネジアを軽減するために、神経遮断薬の用量を減らし、抗コリン薬(ビペリデン、トリヘキシフェニジル)を処方します。遅発性ジスキネジアは通常、頸筋に発症し、急性ジストニア反応とは異なり、抗コリン薬による治療に対する反応性が低いです。神経遮断薬性パーキンソン症候群は、自発運動能力の低下、軽度無感情症、安静時振戦、筋固縮を特徴とします。これらの症状は、感情的疎外、感情鈍麻、無気力といった、統合失調症に見られる外見上類似した陰性障害と鑑別することが重要です。これらの副作用を改善するには、抗コリン薬の使用、神経遮断薬の減量、または非定型抗精神病薬への切り替えが適応となります。アカシジアは、内的不安、長時間同じ場所に留まることができないこと、そして常に手足を動かしたいという欲求を特徴とします。アカシジアの緩和には、抗コリン薬と中枢性β遮断薬(プロプラノロール)が使用されます。
晩発性ジスキネジアは、あらゆる筋群、特に舌筋と口腔筋の不随意運動によって発現します。臨床的には、いくつかの形態が区別されます。頬筋、舌筋、口腔筋のジスキネジア(咀嚼筋の周期的な収縮により、しかめっ面のような印象を与え、舌が口から不随意に突出することがあります)、遅発性ジストニアおよび遅発性アカシジア(頭部、体幹、上肢、下肢の舞踏アテトーゼ様運動)です。この形態の障害は、主に従来の神経遮断薬による長期治療中に認められ、維持療法として神経遮断薬を服用している患者の約15~20%に認められます。一部の患者では、ジスキネジア症状の発現リスクが高まっている可能性があります。なぜなら、これらの症状の一部は「神経遮断薬時代」以前から統合失調症の臨床で観察されていたからです。さらに、高齢女性や気分障害患者において遅発性ジスキネジアが報告されています。遅発性ジスキネジアは線条体におけるドーパミン受容体数の増加と関連していると考えられていますが、GABA作動性神経伝達物質系やその他の神経伝達物質系もその病態に関与している可能性が示唆されています。こうした副作用に対する効果的な普遍的な治療法はありません。ドーパミン遮断作用を持つ高効力神経遮断薬の低用量投与、またはビタミンEの投与は、これらの疾患に中等度の有益な効果をもたらす可能性が示唆されています。遅発性ジスキネジアに対する最も効果的な治療法は、定型神経遮断薬の減量、または非定型抗精神病薬への切り替えです。
最新のデータによると、悪性症候群(NMS)は精神薬物療法の症例の約0.5%に発生します。このような生命を脅かす合併症が稀にしか発生しないのは、非定型抗精神病薬の普及によるものと考えられます。これらの薬剤による治療中にNMSを発症するリスクは軽微です。NMS発症の主な原因は、神経遮断薬による治療中、特に強力な抗精神病薬の増量後に生じるドーパミン作動系の過剰な遮断にあると一般的に考えられています。NMSの主な症状は、高体温、骨格筋および腱反射の緊張亢進、意識障害から昏睡への移行です。血液検査では白血球増多、赤血球沈降速度の上昇、肝トランスアミナーゼ活性が認められ、尿検査ではアルブミン尿が認められます。水分および電解質バランスの異常が急速に進行し、脳浮腫の形成に必要な条件が整います。 NMS(神経筋麻痺)は、集中的な輸液療法のために緊急入院を必要とする急性疾患です。NMSの治療では、水分補給と対症療法が最も重要です。この状態では、処方されている神経弛緩薬は直ちに中止する必要があります。ドパミン受容体作動薬(ブロモクリプチンなど)や筋弛緩薬は、有効性は研究されていませんが、場合によっては効果があることがあります。NMSが消失した後、少なくとも2週間は神経弛緩薬の投与を再開しないでください。その後、低効力の抗精神病薬、できれば新世代の抗精神病薬が処方される場合があります。新たに処方された薬の用量は、生命機能の状態と臨床検査値(血液検査と尿検査)を注意深くモニタリングしながら増量する必要があります。
典型的な神経遮断薬は、まれに危険な致死的合併症を引き起こすことがあります。過剰摂取による症状は、主に薬剤の抗アドレナリン作用および抗コリン作用の個々のプロファイルに関連しています。これらの薬剤は強力な制吐作用を有するため、体内からの排除には催吐剤の投与ではなく、胃洗浄が適応となります。動脈性低血圧は、通常、アドレナリン受容体遮断の結果であり、ドーパミンおよびノルアドレナリンの投与によって是正する必要があります。不整脈の場合は、リドカインの使用が適応となります。
定型抗精神病薬の作用機序と薬理効果
精神薬理学の発展に伴い、抗精神病薬の神経受容体に対する作用については様々な説が提唱されてきました。精神病における脳構造における正常なドーパミン代謝の破綻に関するデータに基づき、抗精神病薬はドーパミン神経構造(主にD2受容体)に作用するという仮説は依然として有力です。ドーパミンD2受容体は、基底核、側坐核、および前頭皮質に存在し、大脳皮質と視床の間の情報伝達を制御する上で重要な役割を果たしています。
この図は、脳の皮質および皮質下領域におけるドーパミン伝達の障害と、これらの障害が統合失調症の症状の発現に果たす役割についてのより詳細な理解を示しています (Jones RB、Buckley PF、2006 年のモノグラフより引用)。
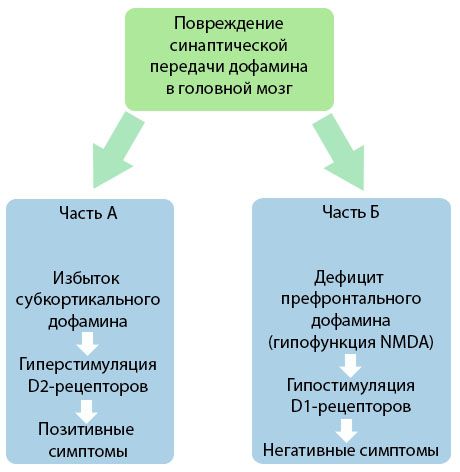
パートAは、初期の古典的なドーパミン理論を反映しており、皮質下領域におけるドーパミン過剰とD2受容体の過剰刺激が生産症状の発現につながると仮定しています。パートBは、1990年代初頭における理論のその後の近代化を示しています。この時点で得られたデータは、D受容体におけるドーパミンの欠乏と、前頭前皮質におけるこれらの受容体の刺激不足が相まって、陰性症状と認知障害の発現につながることを明らかにしました。したがって、現代の理解によれば、皮質下ドーパミン過剰と前頭前皮質におけるドーパミン欠乏という2種類のドーパミン伝達障害は、前頭前皮質におけるシナプス伝達の破綻の複合的な結果であり、N-メチル-N-アスパラギン酸の機能低下と関連しています。当初単離されたドーパミンに加え、後に統合失調症の病態に関与する他の神経伝達物質、例えばセロトニン、γ-アミノ酪酸、グルタミン酸、ノルアドレナリン、アセチルコリン、そして様々な神経ペプチドが特定されました。これらのメディエーターの役割はまだ十分に研究されていませんが、知識が深まるにつれて、体内で様々な神経化学的変化が発現していることが明らかになってきています。したがって、抗精神病薬の臨床効果は、様々な受容体形成に対する効果の総和であり、恒常性障害の解消につながります。
近年、放射性同位元素リガンド結合やPETスキャンといった新たな研究手法の登場により、神経遮断薬の作用機序の詳細な生化学的解明において大きな進歩が遂げられています。特に、脳の様々な領域や構造における個々の神経受容体への薬物の結合強度と指向性の比較が明らかになり、薬物の抗精神病作用の強さが、様々なドパミン受容体に対する遮断作用の強さに直接依存していることが示されています。最近、4種類の受容体が同定されました。
- D1 は主に黒質と線条体 (いわゆる黒質線条体領域) の領域、および前頭前野に位置します。
- D2 - 黒質線条体、中脳辺縁系、および下垂体前葉(プロラクチンの分泌)
- D3(シナプス前) - さまざまな脳構造において、負のフィードバックの法則に従ってドーパミンの活動を制御します。
- D4 (シナプス前) - 主に黒質線条体および中脳辺縁系領域に存在します。
同時に、抗精神病作用、二次的な鎮静作用、そして錐体外路系の副作用の発現は、D2受容体の遮断によって引き起こされることが証明されたと言えるでしょう。このタイプの受容体の遮断によるその他の臨床症状としては、神経遮断薬の鎮痛作用および制吐作用(嘔吐中枢の抑制による吐き気や嘔吐の軽減)、成長ホルモン含量の減少とプロラクチン産生の増加(乳汁漏出や月経不順などの神経内分泌系の副作用)などが挙げられます。黒質線条体のD2受容体の長期遮断は、受容体の過敏性を惹起し、遅発性ジスキネジアや「過敏性精神病」の発症につながります。シナプス前D3およびD4受容体の遮断による臨床症状は、主に神経遮断薬の刺激作用と関連していると考えられます。黒質線条体および中脳辺縁皮質領域のこれらの受容体が部分的に遮断されるため、活性化性および鋭敏性(強力で非常に活性な)神経遮断薬を少量使用するとドーパミン伝達が刺激され、多量使用すると抑制されます。
近年、セロトニン受容体を含む脳のセロトニン作動系の機能への関心が急速に高まっています。事実、脳の様々な部位において、セロトニン作動系はドーパミン作動系構造に調節作用を及ぼしています。特に、中脳皮質領域では、セロトニンがドーパミンの放出を抑制し、その結果、シナプス後5-HT受容体の遮断がドーパミン含量の増加につながります。ご存知のように、統合失調症における陰性症状の発現は、大脳皮質前頭葉構造におけるドーパミンニューロンの機能低下と関連しています。現在、約15種類の中枢性5-HT受容体が知られています。神経遮断薬は主に最初の3種類の5-HT受容体に結合することが実験的に発見されています。
これらの薬剤は、主に5-HT1a受容体に対する刺激作用(作動作用)を有します。予想される臨床的影響:抗精神病薬としての作用の増強、認知障害の重症度の軽減、陰性症状の改善、抗うつ作用、錐体外路症状の副作用発現率の低下。
神経遮断薬の5-HT2受容体、特に5-HT2aサブタイプへの作用は極めて重要です。これらの受容体は主に大脳皮質に局在し、統合失調症患者では感受性が上昇します。新世代の神経遮断薬は、陰性症状の重症度を軽減し、認知機能を改善し、徐波(D波)睡眠段階の総持続時間を延長することで睡眠を調節し、攻撃性を抑え、うつ症状や片頭痛様頭痛(脳血管障害に起因するもの)を緩和しますが、これらは5-HT2a受容体の遮断と関連しています。一方、5-HT2a受容体の遮断は、男性において低血圧や射精障害を引き起こす可能性があります。
神経遮断薬が 5-HT2c 受容体に及ぼす影響により、鎮静(抗不安)効果、食欲増加(体重増加を伴う)、プロラクチン産生の減少が起こると考えられています。
5-HT3受容体は主に大脳辺縁系に存在し、これが阻害されるとまず制吐作用が現れ、抗精神病作用や抗不安作用も増強されます。
パーキンソン病様症状の発現は、薬剤のムスカリン性コリン受容体に対する遮断力にも依存します。コリン遮断作用とドーパミン遮断作用は、ある程度相互関係にあります。例えば、黒質線条体領域では、D2受容体がアセチルコリンの放出を阻害することが知られています。黒質線条体領域のD2受容体の75%以上が遮断されると、コリン作動系に有利なバランスが崩れます。これが、抗コリン薬(補正剤)が神経遮断薬の錐体外路症状の副作用を補正する理由です。クロルプロチキセン、クロザピン、オランザピンはムスカリン受容体への親和性が高く、コリン作動性受容体とドーパミン作動性受容体を同時に遮断するため、錐体外路症状の副作用をほとんど引き起こしません。ハロペリドールおよびピペラジンフェノチアジン誘導体は、ドーパミン受容体には顕著な作用を示すものの、コリン受容体には極めて弱い作用を示す。これは、顕著な錐体外路症状を引き起こす可能性があるためである。高用量を投与すると、コリン作動性作用が顕著になり、錐体外路症状は軽減される。黒質線条体領域のD2受容体に対するドーパミン遮断作用を弱め、錐体外路症状の副作用を緩和するだけでなく、強いコリン作動作用は、記憶障害を含む認知機能の低下や、末梢性副作用(粘膜乾燥、視覚調節障害、便秘、尿閉、錯乱など)を引き起こす可能性がある。神経遮断薬はI型ヒスタミン受容体に対するかなり強い遮断作用を有し、これはまず第一に、鎮静作用の強さ、そして食欲増進による体重増加と関連している。神経遮断薬の抗アレルギー作用や鎮痒作用も、抗ヒスタミン作用と関連しています。
ドーパミン遮断作用、抗セロトニン作用、コリン作動性作用、抗ヒスタミン作用に加え、ほとんどの神経遮断薬は副腎皮質遮断作用、すなわち中枢性および末梢性のα1アドレナリン受容体の両方を遮断する作用も有します。クロルプロマジンやクロルプロチキセンなどの副腎遮断薬は、顕著な鎮静作用を有します。さらに、これらの薬剤の遮断作用は、神経栄養障害の副作用(動脈性低血圧、頻脈など)や、副腎遮断薬の降圧作用の増強を引き起こす可能性があります。
多数の著者の研究により、個々の神経遮断薬とさまざまな種類の神経受容体との結合強度 (親和性) に関するデータが提供されています。
臨床現場で主に使用されている定型抗精神病薬と非定型抗精神病薬は、その作用の神経化学的プロファイルに基づいて、条件付きで 6 つのグループに分けられます。
最初のグループは、ベンザミドおよびブチロフェノン誘導体のグループに属するD2およびD4受容体の選択的遮断薬(スルピリド、アミスプリド、ハロペリドールなど)です。少量投与では、主にシナプス前D4受容体を遮断することにより、ドーパミン神経インパルス伝達を活性化し、刺激(脱抑制)効果をもたらします。一方、大量投与では、脳のあらゆる領域のD2受容体を遮断します。これは臨床的には、顕著な抗精神病作用、ならびに錐体外路症状および内分泌症状(プロラクチン血症に起因する)として現れます。
第2のグループには、強力なD2受容体遮断薬に加え、5-HT2a受容体および5-HT1a受容体を弱くまたは中程度に遮断する薬剤(フルペンチキソール、フルフェナジン、ズクロペンチキソールなど)が含まれます。具体的には、主にフェノチアジンのピペラジン誘導体、または立体化学構造がそれらに近いチオキサンテン類です。第1のグループの薬剤と同様に、これらの神経遮断薬は、まず第一に顕著な抗精神病作用(鋭敏性)を有し、さらに錐体外路症状およびプロラクチン血症を引き起こします。少量では、中程度の活性化作用(精神刺激作用)を示します。
3つ目のグループは、ほとんどの神経受容体を非分化的に遮断する多価鎮静性神経遮断薬です。これらの薬剤はドーパミン受容体に対する明確な遮断作用を有し、強力なアドレナリン遮断作用およびコリン遮断作用も示します。これには、フェノチアジンの脂肪族誘導体およびピペリジン誘導体、ならびに立体化学構造がこれらに近いチオキサンテン(クロルプロマジン、レボメプロマジン、クロルプロチキセンなど)をはじめとする、ほとんどの鎮静性神経遮断薬が含まれます。これらの薬剤の向精神作用スペクトルは、まず第一に、投与量に関わらず発現する顕著な一次鎮静作用と、中等度の抗精神病作用によって支配されています。さらに、このグループの薬剤は、顕著な抗コリン作用があるため、軽度または中程度の錐体外路系および神経内分泌系の副作用を引き起こしますが、α1アドレナリン受容体の顕著な遮断により、起立性低血圧やその他の自律神経反応の発生につながることもよくあります。
第4のグループには、D2受容体と5-HT2a受容体をバランスよく、すなわち同程度(後者はやや強く)に遮断し、α1受容体を中程度に遮断する神経遮断薬が含まれます。このグループには、化学構造が異なる新世代の非定型抗精神病薬(リスペリドン、ジプラシドン、セルチンドール)の代表が含まれます。神経化学的作用機序は、主に脳の中脳辺縁系および中脳皮質領域への選択的な影響を決定します。明確な抗精神病薬効果に加えて、錐体外路系の副作用がないか弱い(治療用量使用時)、プロラクチン血症が弱いまたは中等度であること、副腎皮質の抑制作用(低血圧反応)が中等度であることに加え、このグループの神経遮断薬は、大脳皮質におけるドーパミン伝達の間接的な刺激により陰性症状を改善します。
第5グループは、三環系ジベンゾジアゼピンまたは類似構造の多価非定型抗精神病薬(クロザピン、オランザピン、クエチアピン)で構成されています。第3グループの薬剤と同様に、これらの薬剤はほとんどの神経受容体を非分化的に遮断します。しかし、5-HT2a受容体はD2受容体およびD4受容体よりも強く遮断され、特に黒質線条体領域の受容体は強く遮断されます。これにより、錐体外路作用が実質的に存在しないか弱いことが決定され、プロラクチン産生の増加に関連する神経内分泌の副作用は発生せず、明確な抗精神病作用と陰性症状の重症度を軽減する能力があります。さらに、このグループの薬剤はすべて、顕著な副腎皮質遮断作用と抗ヒスタミン作用を有しており、鎮静作用と降圧作用をもたらします。クロザピンとオランザピンはムスカリン受容体に対してかなり顕著な遮断作用を示し、コリン作動性副作用の発現につながります。
したがって、シナプス後ドーパミン受容体を遮断し、ドーパミンの合成および代謝を代償的に増加させる能力は、これらのグループで検討されるすべての神経遮断薬に共通する唯一の生化学的特性です。
第6のグループには、国内の精神薬理学市場に比較的最近登場した唯一の非定型抗精神病薬であるアリピプラゾールが含まれます。この薬剤はD2ドーパミン受容体の部分作動薬であり、ドーパミン作動性亢進状態では機能的拮抗薬として、ドーパミン作動性低下状態では機能的作動薬として作用します。アリピプラゾールのこのような独特な受容体プロファイルにより、使用時に錐体外路障害や高プロラクチン血症のリスクを低減することが可能になります。さらに、アリピプラゾールは5-HT1a受容体の部分作動薬として作用すると同時に、5-HT2a受容体の拮抗薬としても作用します。このような受容体との相互作用は、セロトニン系とドーパミン系の機能のバランスを全体的に整えると考えられており、アリピプラゾールの作用機序はドーパミン-セロトニン系の安定化と定義できます。
このように、神経遮断薬の神経化学的作用機序に関する現在の知見に基づき、この向精神薬群について、病態学的により裏付けのある新たな薬力学的分類を提案することが可能となりました。この分類を用いることで、特定の薬剤の向精神作用のスペクトル、耐性、そして起こりうる薬物相互作用をある程度予測することが可能となります。言い換えれば、薬剤の神経化学的作用の特徴は、その臨床的作用の特徴を大きく決定づけるものであり、特定の患者に対して特定の抗精神病薬を選択する際には、この特徴を考慮する必要があります。
あらゆる神経遮断薬の全般的な抗精神病薬効果の有効性は、いわゆるクロルプロマジン当量を用いて推定されます。クロルプロマジン当量は1とみなされます。例えば、ハロペリドールのクロルプロマジン当量は50です。これは、ハロペリドール1mgの抗精神病薬効果は、クロルプロマジン50mgに匹敵することを意味します。この指標に基づいて、神経遮断薬を、高い(クロルプロマジン当量> 10.0)、中程度の(クロルプロマジン当量 = 1.0-10.0)、低い(クロルプロマジン当量 = 1.0)抗精神病薬の活性(特許性)に分類する分類が開発されました。定型神経遮断薬(第一世代抗精神病薬)は、ほぼ半世紀にわたって臨床精神薬物療法で広く使用されてきました。その治療効果の範囲は次のとおりです。
- 精神病の様々な症状を均一かつ差別的に軽減する能力という形での全般的な抗精神病薬作用:
- 一次鎮静(抑制)効果 - 薬物が精神運動興奮を素早く緩和する能力。
- 選択的、選択的な抗精神病薬作用は、せん妄、幻覚、欲求の脱抑制など、個々の症状に影響を及ぼす能力として現れます。
- 活性化(脱抑制、脱抑制、抗自閉症)神経向性作用、錐体外路症状の発現として現れる。
- 神経内分泌および栄養副作用の発現という形でのソマトトロピン作用。
- 抑制効果。一部の抗精神病薬がうつ病症状を引き起こす能力として表されます。
第一世代抗精神病薬は、精神病性障害だけでなく境界性精神疾患の治療においてもその有効性が何度も証明されており、議論の余地はありません。そのため、処方時に副作用が頻繁に発生するにもかかわらず、医療現場で使用され続けています。
非定型抗精神病薬
現代のガイドラインには、薬物療法における第二世代抗精神病薬の使用の利点に関するデータが含まれています。「非定型」(同義語:第二世代抗精神病薬)という用語は条件付きであり、主に新世代を指す便宜上使用されています。従来の神経遮断薬と比較して、このグループの薬剤は、陰性障害、情動障害、認知障害の改善に効果的であり、忍容性が高く、錐体外路症状のリスクが低いという特徴があります。一連の非定型抗精神病薬における各薬剤の治療効果の性質の違いは、定型神経遮断薬のグループと同様に、それぞれの薬理作用のプロファイルによって説明されます。
非定型抗精神病薬を用いた精神薬物療法の可能性を明らかにするためには、ロシアで登録されているこのグループの薬剤に焦点を当てることが望ましい。
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
クロザピン(ジベンゾジアゼピン)
非定型抗精神病薬グループの創始者。クロザピンの作用機序は、D2受容体をわずかに遮断すると同時に、5-HT2a受容体、α1、α2アドレナリン受容体、およびH1ヒスタミン受容体に強い拮抗作用を示すことを特徴としています。他の抗精神病薬に耐性がある場合に有効な抗精神病薬(予備群の薬剤)として実証されており、慢性躁病、精神病性興奮、攻撃性の治療にも適応があります。国内診療において、クロザピンは精神病患者の鎮静および睡眠薬として処方されることがよくあります。このようなクロザピンの使用は、治療における主な適応プロファイルと一致しないことを認識する必要があります。今日、この抗精神病薬は耐性患者に対する効果が実証されている唯一の薬剤であるため、この抗精神病薬を副次的な薬剤とみなす考え方は見直されるべきでしょう。
クロザピンは、典型的な神経遮断薬とは異なり、前述のようにO2受容体への親和性が低いため、重篤な錐体外路障害を引き起こすことはありません。また、遅発性ジストニアや重度のアカシジアの治療にも使用できることが分かっています。NMSの発症リスクが低いため、クロザピンは過去にこの合併症を患った患者にとって最適な薬剤と考えられます。
しかし、クロザピン療法中には、いくつかの重篤な副作用が生じる可能性があります。その中で最も危険な副作用(少量を処方した場合でも)は無顆粒球症で、患者の0.5~1.0%に発生します。この薬の使用中に発生する可能性のあるその他の重要な副作用には、眠気、流涎過多、体重増加などがあり、これらの体重増加は、以前の抗精神病薬療法の影響により、クロザピンが処方される頃にはすでに増加している場合がよくあります。服用中は、頻脈、動脈性低血圧、てんかん発作を発症する可能性にも注意する必要があります。発作の可能性は用量に依存します。クロザピンの用量が1日600 mgを超えると、発作のリスクが大幅に増加します。発作の発生は、この薬の継続使用の禁忌ではありませんが、用量を半分に減らし、バルプロ酸などの抗てんかん薬を処方する必要があります。クロザピン治療の副作用の予防には、白血球数のほか、心電図や内分泌パラメータの注意深いモニタリングが含まれます。
クロザピンの過剰摂取は、昏睡に至る意識低下、コリン分解作用に伴う症状(頻脈、せん妄)、てんかん発作、呼吸抑制、錐体外路症候群を引き起こす可能性があります。2500mgを超える用量を服用すると、致死的な結果に至る可能性があります。
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
リスペリドン
セロトニンおよびドーパミンDj受容体への高い親和性を有し、主にセロトニン系に作用するベンゾイソキサゾール誘導体。本剤は、増悪の緩和、再発防止、初回精神病エピソードの治療、統合失調症の陰性症状の改善など、幅広い適応症を有しています。本剤は、統合失調症患者の認知機能を改善することが示されています。リスペリドンは、統合失調症患者の併存する感情症状を軽減する作用も有するという予備的なデータが得られており、双極性感情障害の治療における選択薬となる可能性があります。
リスペリドン療法の副作用、特に錐体外路障害は用量依存性があり、6mg/日を超える用量でより頻繁に発現します。その他の副作用としては、吐き気、嘔吐、不安、眠気、血清プロラクチン値の上昇などがあります。リスペリドンの長期使用は体重増加や2型糖尿病の発症につながる可能性がありますが、クロザピンやオランザピンと比較するとその可能性は低いです。
過量投与は、傾眠、てんかん発作、QT間隔の延長およびQRS波の拡大、動脈性低血圧を引き起こす可能性があります。リスペリドンの過量投与による致死的転帰の症例が報告されています。
この薬の明白な利点は、液状と速溶性(舌下)の形態が利用可能であることです。これらの形態を使用することで、患者の体内への薬剤の吸収が促進され、摂取量の制御が容易になります。また、筋肉内投与用懸濁液(マイクロスフェア中のコンスタリスペリドン)を調製するための粉末という、薬剤の持続型もあります。これは、統合失調症患者の維持療法、特に服薬コンプライアンスが低い患者に推奨されます。この薬剤が血流に入るまでに約3週間かかるという事実を考慮する必要があります。したがって、コンスタリスペリドンによる治療を開始する場合、患者は最初の注射後少なくとも3週間、経口リスペリドンを追加で服用する必要があります。
オランザピン
薬理作用に関しては、セロトニン、ムスカリン、α1アドレナリン、ヒスタミン受容体に高い親和性を示す多形性受容体プロファイルを有するため、クロザピンに近い。オランザピンの治療活性は、統合失調症の陽性症状、陰性症状、および抑うつ症状への影響という点で、クロザピンおよびリスペリドンの有効性と同様の特徴を有する。同時に、初回精神病エピソード患者および認知機能指標の修正において、オランザピンは他の非定型抗精神病薬と比較して高い有効性を示すデータが得られている。錠剤を用いた治療開始時には、精神運動興奮および不安の増加を伴う急速な脱抑制効果が現れる可能性があることに留意する必要がある。したがって、重度の精神運動興奮を伴う発作の治療には、注射剤の使用が適応となる。
オランザピンは錐体外路障害や遅発性ジスキネジアを引き起こすことは稀で、その使用に伴う最も一般的な副作用は代謝障害と体重増加です。オランザピンを投与された患者では、コレステロール値、血漿脂質値の上昇、および2型糖尿病の素因がかなり頻繁に発現することが確認されていますが、これらの影響はオランザピンとクロザピンの両方を投与された患者にも同程度に認められました。同時に、体重増加はオランザピンに対する良好な反応と相関し(つまり、治療の重要な予後指標となる)、治療中に過剰体重が増加した患者のうち、わずか20~30%でのみ肥満へと進行するというデータも得られています。
過剰摂取は、鎮静、毒性抗コリン作用、てんかん発作、および動脈性低血圧を引き起こす可能性があります。現在、過剰摂取による死亡リスクを評価するための説得力のあるデータはありません。
クエチアピン
ジベンゾチアゼピン系化合物に分類されます。受容体プロファイルはクロザピンとほぼ同様です。クエチアピンのD2受容体への結合レベルは低く(50%未満)、高用量を投与しても効果は短期間です。この薬剤は、統合失調症の陽性症状、陰性症状、および全般症状の治療に有効です。治療抵抗性が高い場合や、患者の認知機能を改善する場合に有効であるというエビデンスがあり、統合失調症の維持療法における第一選択の抗精神病薬として推奨されています。さらに、クエチアピンは中等度の抗うつ作用と賦活作用を有します。そのため、うつ病妄想発作および精神・心気症群の障害の治療に適応があります。
クエチアピンは、その高い甲状腺刺激作用が確立されていることから、うつ病の緩和および二次予防の薬として承認されています。I型およびII型の双極性障害における躁病エピソードの治療には、クエチアピンは補助的な薬として用いられます。注射剤がないため、興奮性および攻撃的な行動を示す患者への使用はやや制限されます。
クエチアピンは忍容性に優れており、最大用量を投与した場合を除き、錐体外路症候群を引き起こすことはほとんどありません。クエチアピンは高プロラクチン血症を引き起こすことはありませんが、オランザピンやクロザピンほど頻繁には起こりません。ただし、体重増加や耐糖能障害を引き起こすことはあります。
ジプラシドン
独特な受容体活性プロファイルを有します。5HT2a受容体およびD2受容体の強力な拮抗薬であるだけでなく、セロトニンおよびノルアドレナリンの再取り込みを阻害する活性阻害剤でもあります。臨床試験では、ジプラシドンはハロペリドールと比較して、精神病症状および攻撃性発現に対する効果が著しく優れていることが実証されています。また、統合失調症患者の認知機能、併存する感情症状、社会機能の指標に対するジプラシドンの良好な効果に関するデータもあります。ジプラシドンは通常、忍容性が高く、錐体外路症候群、体重増加、代謝障害を引き起こすことは非常にまれです。QT間隔の延長は460msを超えることが多いため、この薬剤を服用する患者は、処方前および治療中のモニタリング中に心電図検査を受けることをお勧めします。併用療法(抗不整脈薬の服用)はQT間隔の延長を悪化させ、不整脈、心室細動の発症につながる可能性があるため、特に注意が必要です。
セルチンドール
フェニルインドール誘導体に属し、D2受容体、セロトニン受容体(特に5-HT2a受容体)、およびα1アドレナリン受容体に対して高い機能拮抗作用を示す。電気神経化学的研究によると、セルチンドールは腹側節領域のドーパミン受容体を選択的に阻害する。この選択性により、本剤使用時の錐体外路症候群および高プロラクチン血症のリスクは低いと考えられる。比較研究の結果、セルチンドールは抗精神病薬としての活性においてハロペリドールに匹敵することが示された。本剤は、陰性症状および抑うつ症状を有する患者において顕著な脱抑制作用を示し、リスポレプトの同様の作用よりも優れている。また、統合失調症患者の認知機能障害の改善におけるセルチンドールの有効性を裏付けるエビデンスも存在する。セルチンドールは一般に患者の忍容性が良好で、鎮静作用を引き起こすことはほとんどないため、他の現代の抗精神病薬による治療中に副作用が発生した場合の代替薬として推奨されます。
重篤な副作用としては、QT間隔を延長させる作用があり、不整脈を引き起こす可能性があります。市販後調査の解析により、セルチンドールの心臓への影響は他の新世代抗精神病薬と変わらないことが明らかになりました。
アリピプラゾール
本剤は他の非定型抗精神病薬と同等の抗精神病作用を有しますが、統合失調症患者の認知機能パラメータへの影響はより大きくなります。前述のD2受容体の部分作動薬である本剤の独自の薬理作用により、錐体外路症候群および高プロラクチン血症のリスクを低減します。
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
アミスルプリド
置換ベンズアミド系薬剤に分類されます。本剤は、D2およびD3ドーパミン受容体のサブタイプに選択的に結合し、D1、D4、D5サブタイプ、ならびにセロトニン、H1ヒスタミン、α1アドレナリン、コリン受容体には親和性を示しません。高用量で使用すると、シナプス後D2受容体を遮断します。低用量では、シナプス前D2、D3受容体の遮断による脱抑制効果が発現するため、D2受容体とセロトニン受容体の複合拮抗薬ではありませんが、陰性症状の治療にも有効です。多くの研究結果から、高用量で使用すると、従来の薬剤よりも優れた抗精神病薬としての効果が顕著に現れることが示されています。
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
抗精神病薬療法の副作用
この表には、非定型抗精神病薬療法の主な副作用が記載されています。
準備 |
錐体外 |
心電図上の伝導障害 |
代謝障害(体重増加、血糖値、コレステロール値、トリグリセリド値の上昇) |
||
クロザピン |
。 |
++ |
++ |
++- |
|
リスペリドン |
++ |
+/- |
++ |
+/- |
|
オランザピン |
+ |
+/- |
+++ |
++ |
+++ |
クエチアピン |
+/- |
+ |
+/- |
--- |
|
ジプラシドン |
+ |
++ |
+/- |
+/- |
+/- |
セルチンドール |
++ |
-- |
+/- |
-- |
|
アリリプラゾール |
-- |
--- |
+/- |
-- |
-- |
アミスルプリド |
++ |
+/- |
|||
注記: 副作用の重症度: 「+++」 - 高、「++」 - 平均、「+」 - 低、「+/-」 - 疑わしい、「-」 - なし。
錐体外路症候群
非定型抗精神病薬の主な特徴の一つは、従来の抗精神病薬と比較して、錐体外路症候群の発現率が低いことです。これは統合失調症の維持療法における画期的な進歩となりました。しかしながら、表のデータからもわかるように、このシリーズの個々の薬剤(リスペリドン、アミスルプリド)の使用時には、このような症状が発現する可能性があり、処方時には特別な注意が必要です。
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
心電図異常
一部の現代抗精神病薬を治療に使用する場合、心臓への副作用の発生は深刻な問題となります。これらの副作用とは、QT間隔の延長を指し、不整脈の発症につながる可能性があります。伝導障害、特にQT間隔の延長は、クロザピン、セルチンドール、ジプラシドンによる治療中に最も多く観察されます。徐脈、房室ブロック、甲状腺機能低下症といった併存疾患は、これらの薬剤による治療中にこの合併症の発生に寄与する可能性があります。現在、非定型抗精神病薬による維持療法を受けている患者には、約3ヶ月に1回の心電図モニタリングが推奨されています。
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
内分泌疾患
現在、最大の懸念は、非定型抗精神病薬が体重増加を引き起こす可能性があることです。体重、血糖値、トリグリセリド値の上昇は、代謝障害や2型糖尿病の発症につながる可能性があります。クロザピンとオランザピンによる治療中は、細心の注意を払い、生化学的パラメータを毎週モニタリングする必要があります。J. Geddes et al. (2000)、PB Jones、PF Buckley (2006) によると、遺伝的素因、体重過多、脂質スペクトル障害、治療開始前に高血糖を患っていた患者では代謝障害がより多く発生することが知られているため、特定の現代世代の抗精神病薬を処方する前に、患者を徹底的に検査することが適切であると認識されるべきです。PB Jones、PF Buckley (2006) が提案したモニタリングアルゴリズムには、いくつかのポイントが含まれています。
- 代謝障害のリスクに関する病歴および家族要因の収集。
- 治療開始前にBMI、心電図、血圧、脈拍を記録します。
- 治療を開始する前に検査データ(血糖値、脂質プロファイル、コレステロール)を収集します。
- 治療中はBMIとバイタルサインを定期的にモニタリングします。
- 治療中の検査データのモニタリング。
抗精神病薬療法中に高プロラクチン血症が発生する原因は、視床下部のドーパミン受容体の中枢遮断であり、その結果、下垂体前葉からプロラクチンが放出されます。高プロラクチン血症は、オランザピン、リスペリドン、アミスルプリドによる治療で最も多く発生します。
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
無顆粒球症
抗精神病薬療法のもう一つの深刻な合併症。クロザピンおよびオランザピンによる治療中に観察されることがあります。J. Geddesら(2000)によると、これらの薬を服用している患者の最初の3ヶ月間に1~2%で診断されました。この点で、これらの薬を服用している患者には、治療開始後18週間は毎週血液検査を行い、その後は毎月モニタリングすることが推奨されます。上記の神経遮断薬の投与量を減らすと、臨床血液検査は正常に戻ることが示されています。同時に、これまでのところ、代謝障害に関連する上記の副作用を経験する患者に対する明確な戦略がないことを認識する必要があります。ほとんどの場合、ある非定型抗精神病薬は別の薬に置き換えられます。もう一つの有望な方向性は、特別な矯正療法、特に高プロラクチン血症を矯正するためのブロモクリプチンの使用です。理想的な状況とは、そのような疾患を持つ患者のケアが、内科医、特に内分泌科医、心臓専門医、その他の専門家の定期的な関与のもとで行われることです。
結論として、患者の精神状態だけでなく身体状態も処方および監視するための所定のアルゴリズムに従えば、第二世代の薬剤の使用は一般的な神経遮断薬よりも安全であることに留意すべきです。
現在、他にも多くの抗精神病薬が開発段階にあります。次世代の薬剤は、異なる作用機序(例えば、GABA作動性プロファイル)を有し、統合失調症の様々な症状、特に欠陥性障害に影響を及ぼすことが期待されます。
注意!
情報の認識を簡素化するため、この薬物の使用説明書は、薬物の医療使用に関する公式の指示に基づいて特殊な形で翻訳され提示されています。神経遮断薬または抗精神病薬
説明は情報提供の目的で提供され、自己治癒の手引きではありません。 この薬物の必要性、治療レジメンの目的、薬物の投与方法および投与量は主治医によってのみ決定される。 自己投薬はあなたの健康にとって危険です。


