抗精神病薬、または抗精神病薬
最後に見直したもの: 09.08.2022
典型的な抗精神病薬の予約の適応
現在、精神薬理療法の分野における権威ある研究者の勧告に従った伝統的な神経弛緩薬の任命の主な適応症のうち、以下が挙げられる。
- 重度の精神病症状によって引き起こされる精神運動の興奮および行動障害の刺激。幻覚、妄想性障害(ハロペリドール、トリフルオ)への影響の形で - このような場合には、抗精神病薬の両方のグローバル(hlopromazin、レボメプロマジン、thioproperazine、ズクロペンチキソール)の作用および選択を有する経口または非経口製剤の使用を示します。
- 抗レトロウイルス(予防的)療法。この目的のために、特に資源の乏しい服薬コンプライアンス(デカン酸ハロペリドール、長期フォームフルペンチキソール)、またはdezingibiruyuschegoため中小用量の薬物(antinegativnogo)効果、患者において、デポー製剤を投与し、高用量は、リリーフのために使用されます急性精神病性疾患(フルペンチキソール、ズクロペンチキソール)。治療のこのタイプのうつ病極とdissomnicheskie障害の発現に影響から成るいわゆる小抗精神病薬(チオリダジン。Chlorprothixenum、スルピリド)、精神活動の予定をお勧めします。
- 急性精神病状態を管理する際の非定型抗精神病薬に対する治療抵抗性の克服。この目的のために、使用することは、一般的にグローバル(クロルプロマジン、レボメプロマジンら)と選択(ハロペリドール)、抗精神病作用を有する経口の形の伝統的な抗精神病薬です。
これらの薬剤は、様々な副作用を引き起こすの性質は、各製剤の薬理学的プロファイルの機能に依存します。より顕著に抗コリン作用をもつ抗精神病薬は、より多くの可能性調節障害、便秘、口渇を引き起こします。尿の保持。ブロッキング剤のA1-アドレナリン受容体 - 鎮静は、より顕著な抗ヒスタミン作用および起立性低血圧を有する典型的な抗精神病薬です。封鎖典型的な神経のコリン作動性、およびドーパミン作動性伝達nordrenergicheskoyは、無月経および月経困難症、無オルガスム症、乳汁、腫れ及び痛み胸部腺、減少効力として性的球における障害の数をもたらすことができます。性器エリアの副作用は、主にholino-アドレナリン受容体遮断特性やこれらの薬剤に関連した、だけでなく、されている - ドーパミン代謝の遮断による増加プロラクチン分泌を持ちます。典型的な神経遮断薬の最も深刻な副作用は、運動機能の侵害である。患者が投薬を拒否する最も一般的な理由です。モータ球上の影響に関連した治療の三つの主要な副作用のために、初期の錐体外路症候群、遅発性ジスキネジア、およびNSAが挙げられます。
錐体外路症候群は、基底核におけるD2受容体の遮断とともに、関連していると考えられている。ジストニア、神経弛緩パーキンソニズム、座瘡が含まれます。急性ジストニー反応(早期ジスキネジー)の症状は、突然、興奮、眼球運動の危機、顔面および胴体の筋肉の収縮、opisthotonusを発症する。これらの障害は用量依存性であり、ハロペリドールおよびフルフェナジンのような高級神経遮断薬による2〜5日間の治療後にしばしば生じる。早期ジスキネジーを止めるには、神経遮断薬の投与量を減らし、抗コリン薬(ビペリデン、トリエキシフェニジル)を処方する。遅発性ジスキネジーは、通常、頚部の筋肉を伴い、急性ジストニー反応とは対照的に、抗コリン作動薬によって治療されにくい。自発運動、次亜とamimia、安静時振戦および剛性に還元能力によって特徴付け神経パーキンソンため。これらの症状は、精神的疎外、感情の鈍化およびアネルギーに代表される、統合失調症における外見的に類似の負の障害と区別するために重要である。これらの副作用を修正するために、抗コリン作用薬の使用、神経弛緩薬の用量の減少または非定型抗精神病薬によるその置換が示される。Akathisiaは、内部の不安、長い間1か所にいないこと、常に手や足を動かす必要があることから明らかです。救済のためには、抗コリン作用薬、中枢β遮断薬(プロプラノロール)を使用してください。
遅発性ジスキネジーは、筋肉群の不随意運動、より頻繁には舌と口の筋肉で現れる。臨床的にそのフォームの数を区別:ジスキネジア頬の筋肉、舌、口の中(咀嚼筋の再発減少は、しかめっ面の男の印象を作成し、言語が誤って患者の口から突出していてもよいです)。遅発性ジストニアおよび遅発性座瘡; (患者は、頭部、胴体、上肢および下肢の脊柱脊髄動脈の運動を行う)。このタイプの障害は、伝統的な抗精神病薬による長期治療に主に登録され、維持療法として使用した患者の約15-20%で検出されます。それらのいくつかは前に統合失調症の診療所で観察されているので、おそらく、一部の患者では、ジスキネジアの症状を発症する危険は、増加した「神経弛緩時代。」さらに、遅発性ジスキネジーは、高齢の女性および情動障害の患者に記載されている。その病因はおそらくGABA作動性および他の神経伝達物質系が関与しているが、遅発性ジスキネジアが線条体におけるドーパミン受容体の数の増加に関連付けられているものとします。このような副作用の効果的な普遍的治療は存在しない。ドーパミン遮断作用またはビタミンEを有する非常に強力な抗精神病抗精神病薬の小用量の投与は、これらの障害において中等度の有益な効果を有し得ることが示唆される。遅延性ジスキネジーの最も有効な手段は、典型的な神経弛緩薬の用量の減少または非定型抗精神病薬によるその置換である。
現代のデータによると、悪性神経弛緩症候群は、精神薬理学療法の約0.5%に認められる。おそらく、現時点でこのような生命を脅かす合併症の出現頻度は、非定型抗精神病薬の実践への広範な導入によって説明することができます。NSAのリスクは無視できるためです。NSAの発症の主な理由は、神経遮断薬による治療において、特に高級抗精神病薬の投与量を増加させた後のドーパミン作動薬の過剰遮断であると一般に信じられている。NSAの主な症状は、高体温、骨格筋および腱反射の緊張の増加、昏睡状態への移行に対する意識の侵害である。血液検査では、白血球増多、赤血球沈降速度の増加、肝臓トランスアミナーゼの活性、尿の分析では、アルブミン尿症の存在が注目される。水と電解質のバランスが急速に変化し、脳の浮腫の形成の前提条件が形成されます。ZNSは、集中的な注入療法のために患者の緊急入院を必要とする急性症状である。NSAの治療は、最も重要な水分補給および対症療法である。このような状況では、処方された抗精神病薬は即座に撤回する必要があります。ドーパミン受容体アゴニスト(例えば、ブロモクリプチン)または筋弛緩薬は、その有効性が研究されていないにもかかわらず、効果がある場合もある。NSAを取り除いた後、少なくとも2週間は抗精神病薬の服用を再開すべきではありません。将来、低悪性度の抗精神病薬、好ましくは新世代の薬剤を処方することが可能である。重要な機能や検査データ(血液検査、尿検査)の状態を監視し、新たに処方された治療法の用量を非常に慎重に増やす必要があります。
典型的な神経遮断薬は、比較的致命的な合併症を引き起こすことは比較的まれです。過剰摂取の主な原因は、薬物の抗アドレナリン作用および抗コリン作動作用の個々のプロフィールに関連する。これらの薬剤は強力な鎮吐効果を有するため、胃洗浄は、嘔吐物の投与ではなく体内から除去することが示されている。動脈低血圧は、原則として、アドレナリン受容体の遮断の結果であり、ドーパミンおよびノルエピネフリンの投与によって矯正されるべきである。心拍数が乱れると、リドカインの使用が指示される。
典型的な抗精神病薬の作用メカニズムと薬理作用
精神薬理学の発展に伴い、神経受容体に対する抗精神病薬の影響の様々な変種が提案された。主なものは、脳の構造における正常なドーパミン代謝の精神病の障害に関するデータに基づいて、ドーパミン神経構造(主としてD2受容体)に対するそれらの効果についての仮説である。ドーパミンD2受容体は、基底核、隣接する核および前頭葉の皮質に位置し、皮質と視床との間の情報の流れを調節する主導的役割を果たす。
図は、(RVジョーンズ、バックリーPF、2006年の本から適応)は、脳と統合失調症の症状の開発におけるこれらの疾患の役割の皮質と皮質下の地域におけるドーパミン伝達の違反の洗練されたプレゼンテーションを示しています。
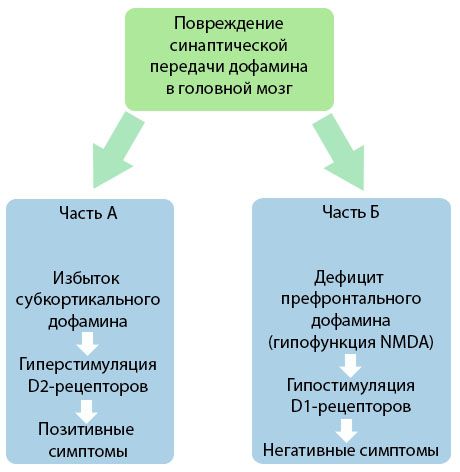
パート「」古典、ドーパミンを表し、早期の理論は、生産的な症状につながる、皮質下領域の過剰刺激およびD2受容体におけるドーパミンの過剰を仮定する。パート「B」は、90年代初期の理論のその後の近代化を示しています。最後の世紀。この時間までに得られたデータは、受容体Dにおけるドーパミンの欠乏; 一緒に前頭前野受容体の刺激の欠如とは、陰性症状や認知障害につながります。したがって、現在の理解によれば、ドーパミン作動性伝達の障害の両方のタイプ - 過剰と前頭前皮質における皮質下ドーパミン欠乏は - N-メチル-N-アスパラギン酸に関連した前頭前野および機能低下におけるシナプス伝達の違反の累積結果です。また、元々ドーパミンを単離し、後に同定し、そしてそのようなセロトニン、gammaaminobutirovaya酸、グルタミン酸、ノルエピネフリン、アセチルコリンおよび種々の神経ペプチドのような統合失調症の病因に関与する他の神経伝達物質、。これらのメディエーターの役割は完全には理解されていないが、しかし、知識の開発と、それは明らかになっている体内で数多くの神経化学変化の現れ。したがって、抗精神病薬の効果の臨床効果は、恒常性の乱れを排除するために、種々の受容体の形成および鉛の合計です。
近年、放射性同位体リガンドとスキャニングPETとの結合以来の新しい研究方法の出現に関連して、神経遮断薬の微妙な生化学的メカニズムを解明する分野において著しい進歩が見られた。特に、脳の種々の領域および構造における個々の神経受容体への結合のための薬物の比較強度および指向性が決定される。種々のドーパミン作動性受容体に対するそのブロッキング効果の強さに対する薬物の抗精神病効果の直接的依存性が示されている。最近、これらの受容体の4つのタイプが区別される:
- D1は主に黒質の領域および線条体(いわゆる黒質線維領域)ならびに前頭葉領域に位置し、
- D2 - ニグロストリア、中脳辺縁領域および下垂体前葉(プロラクチン分泌);
- D3(シナプス前) - 脳の様々な構造において、負のフィードバックの法則に従ってドーパミン作動活性を制御する;
- D4(シナプス前シナプス) - 主にニグロストリアおよび中東辺縁領域にある。
しかし、現時点でそれ封鎖D2受容体は、この受容体タイプの遮断の他の臨床症状では抗精神病薬、二次鎮静効果や錐体外路系副作用の開発を引き起こしているという事実によって証明とみなすことができる(神経弛緩薬の鎮痛及び制吐剤行動している嘔吐、吐き気を減らしますHAを含む)嘔吐中枢の阻害をもたらす、及び成長ホルモンの減少およびプロラクチンの増加(神経内分泌副作用 月経不順など)。D2受容体nigrostrialnyh長時間遮断は遅発性ジスキネジアの開発を担当して彼らの過敏症につながり、「過敏症の精神病。」シナプス前封鎖D3-およびD4受容体の可能な臨床症状は、主に神経の刺激効果と関連しています。nigrostrialnoy mezolimbokortikalnoyにおけるこれらの受容体の部分的な遮断に起因し、ドメインと鋭い(強力な、ハイレベル)を活性化する小用量で神経弛緩を刺激し、高用量でドーパミン作動性伝達を阻害することができます。
近年、セロトニン受容体を含むセロトニン作動性脳系の機能への関心が急速に高まっている。事実、脳の異なる部分において、セロトニン作動系はドーパミン作動性構造に調節効果を有する。特に、中皮質領域において、セロトニンはドーパミンの放出をそれぞれ阻害し、シナプス後5-HT受容体の遮断はドーパミンレベルの上昇をもたらす。知られているように、統合失調症における陰性症状の発症は、大脳皮質の前頭前野構造におけるドーパミンニューロンの機能低下と関連している。現在、約15種類の中枢5-HT受容体が知られている。神経遮断薬は主に最初の3つのタイプの5-HT受容体に結合することが実験的に判明している。
5-HT1a受容体では、これらの薬物は主に刺激作用(アゴニスト作用)を有する。予想される臨床的結果; 抗精神病活性の強化、認知障害の重症度の低下、陰性症状の矯正、抗うつ効果および錐体外路副作用の数の減少が含まれる。
これは、特に5-HT2Aサブタイプのための5-HT2受容体の抗精神病効果のために不可欠です。彼らは主に大脳皮質で発見され、その感度は、統合失調症患者で増加しています。新世代の抗精神病薬の結合能、5-HT2A受容体の遮断と(sosudistoを生じる攻撃性を低減し、抑うつ症状及び偏頭痛を減衰させるために、低速波(L波)睡眠段階の全持続時間を増加させることにより睡眠を調整する、認知機能を改善する、陰性症状の重症度を軽減脳障害)の頭痛。一方、5-HT2A受容体の遮断は、男性における降圧効果と異常射精を得てもよいです。
5-HT2C受容体のための神経弛緩薬への曝露が鎮静(抗不安)効果、及びプロラクチンの減少(体重の増加を伴う)増加食欲を引き起こすと考えられています。
5-HT3受容体は大部分が辺縁領域に見出され、それらの遮断は主として制吐作用を発達させ、また抗精神病薬および抗不安薬効果を高める。
パーキンソン様症状の発生もムスカリン性コリン作動性受容体に対する遮断する薬剤の力に依存します。Holinoliticheskoeとある程度dofaminblokiruyuscheeアクションは相反関係にあります。領域nigrostrialnoyにD2受容体は、アセチルコリンの放出を阻害すること、例えば、知られています。ときに75%以上D2受容体nigrostrialnoyフィールドバランスの遮断は、コリン作動系に有利に乱されます。これは、抗コリン薬(オフセット)の神経弛緩錐体外路副作用の影響を補正するための理由です。クロルプロチキセン、クロザピンおよびオランザピンは、ブロックのコリン作動性及びドーパミン作動性受容体の両方以来、ムスカリン受容体に対して高い親和性を有し、錐体外路系副作用の実質的に欠いています。ハロペリドールおよびフェノチアジン、ピペラジンシリーズは、ドーパミン受容体に対する顕著な効果を持っているが、コリンにはほとんど影響。これはholinoliticheskoe影響が顕著になったときに非常に高用量を使用した場合に減少している錐体外路系副作用を誘発する能力によるものです。D2受容体のdofaminblokiruyuschegoアクションnigrostrialnoy地域を削減し、錐体外路系副作用を平準化することに加えて、強力なコリン作動性の影響は、mnestic障害、および末梢副作用(乾燥粘膜、目のかすみの宿泊施設、便秘、尿閉などの認知機能の低下を引き起こす可能性があり混乱など)。十分に強力なブロッキング神経弛緩薬は、ヒスタミン受容体への影響が原因食欲増加に、特に、これに関連し、鎮静および体重増加の重症度をI型発揮します。抗アレルギーおよび止痒効果の抗精神病薬はまた、抗ヒスタミンの性質と結合します。
ドーパミン遮断、抗セロトニン作動性、抗コリン作動性および抗コリン作動性効果に加えて、大部分の抗精神病薬は、副甲状腺機能を有する。中枢および末梢α1 - アドレナリン作動性受容体の両方を遮断する。そのようなアドレノブロック剤は、クロルプロマジンおよびクロルプロキシンとして、顕著な鎮静作用を有する。加えて、これらの薬物の遮断効果は、副作用の副作用(動脈低血圧、頻脈など)の原因であり、アドレノロッカの降圧効果を強化する。
多数の著者の研究では、個々の神経弛緩薬と様々な種類の神経受容体との結合力(親和性)に関するデータが示されている。
神経化学的プロファイルによれば、主に臨床診療で使用される典型的な抗精神病薬および非定型抗精神病薬を条件付きで6つのグループに分けることができる。
最初のグループは、グループベンズアミドおよびブチロフェノン誘導体の選択的ブロッカーはD2-及びD4受容体(スルピリド、amisudprid、ハロペリドールら)を含みます。小さな、それらがドーパミン作動性神経伝達を活性化し、大用量で刺激(dezingibiruyuschee)作用を有するシナプス前D4受容体の遮断に主として用量 - 臨床的にマニフェストは抗精神病効果を顕著全ての脳領域におけるブロックD2受容体、ならびに錐体外路系および内分泌(プロラクチン血症の観点から)副作用による。
5,5-HT1A受容体(フルペンチキソール、フルフェナジン、ズクロペンチキソールら)、すなわち、 - 第2のグループは、高度にD2受容体遮断薬、ならびに弱いまたは適度NT2aを遮断する薬剤を含みます 主にフェノチアジンまたはチオキサンテンのピペラジン誘導体を立体化学構造においてそれらに近接させる。薬の最初のグループとしては、神経弛緩薬は、最初にすべての、著しい抗精神病薬(鋭い)アクションだけでなく、原因の錐体外路効果とpeochnyeプロラクチン血症、持っています。少量では、適度に活性化(精神刺激)効果があります。
3番目のグループは構成されています。多価鎮静性神経弛緩薬、神経受容体のほとんどを未分化である。これらの薬物は、ドーパミン受容体に対して明らかに発現しているブロッキング効果を有し、また強力なアドレナリン作動性およびコリン作動性効果を引き起こす。これらは、ほとんどの神経弛緩薬は、フェノチアジンの主に脂肪族およびピペリジン誘導体を鎮静、および立体化学構造チオキサンテンでそれらに近い含む(クロルプロマジン、レボメプロマジン、クロルプロチキセンら)。これらの薬物のスペクトル向精神活性は関係なく、適用される用量および軽度の抗精神病効果の開発主に顕著な鎮静プライマリ支配されます。さらに、発音軽度または中等度の錐体外路の副作用および神経内分泌の原因となるが、多くの場合、起立性低血圧やその他の自律神経の反応による表現A1-アドレナリン受容体遮断薬の開発につながるholinoliticheskogoによる薬のこのグループ。
.. A1アドレナリン受容体 - 第四グループは、神経弛緩薬、バランス、すなわち均等ブロッキングD2-及び5-HT2A受容体(後者はややある)と適度を含みます。このグループは、非定型抗精神病薬(リスペリドン、ジプラシドン、セルチンドール)の新世代の代表、異なる化学構造を備えています。行動の神経化学的メカニズムは、主に脳と中間皮質の中脳辺縁系領域に彼らの選択的効果を決定します。異なる抗精神病効果または軽度または中等度の弱い錐体外路系副作用(治療用量を使用した場合)の欠如、および適度プロラクチン血症アドレナリン特性(低血圧反応)とともに、このグループは、神経弛緩薬を脳皮質におけるドーパミン作動性伝達の刺激により媒介陰性症状を修正することができます。
第5群は、三環式ジベンゾジアゼピンの多価非定型抗精神病薬またはそれに近い構造(クロザピン、オランザピンおよびクエチアピン)からなる。第3群の薬物のように、彼らは神経受容体のほとんどを不安定に遮断する。しかしながら、5-HT2a受容体はD2およびD4受容体よりも強く遮断し、特に黒質領域に位置する。これは実際の錐体外路効果の不在または弱を決定し、明確な抗精神病効果を有するプロラクチンの産生増加および陰性症状の重症度を低下させる能力に関連する神経内分泌副作用の欠如を決定する。さらに、この群のすべての薬物は、鎮静作用および降圧作用を決定する顕著なアドレナリンおよび抗ヒスタミン特性を有する。クロザピンおよびオランザピンは、ムスカリンレセプターに対してもかなり顕著なブロッキング効果を有し、コリン分解性副作用の発生をもたらす。
したがって、ドーパミンの合成および代謝の代償的増強を伴うシナプス後ドーパミン作動性受容体を遮断する能力は、これらの群で試験したすべての神経遮断薬の唯一の一般的な生化学的特性である。
第六のグループには、これまで国内の精神薬理市場に比較的最近登場した唯一の非定型抗精神病薬アリピプラゾールが含まれています。この薬物は、D2-ドーパミン受容体の部分アゴニストであり、高ドーパミン作動状態の機能的アンタゴニストとして、および低ドーパミン作動性プロファイルの機能的アゴニストとして作用する。アリピプラゾールのこの独特な受容体プロファイルは、それが使用される場合の錐体外路障害および高プロラクチン血症のリスクを低減することを可能にする。さらに、アリピプラゾールは、5-HT1a受容体の部分アゴニストとして作用すると同時に、5-HT2a受容体のアンタゴニストである。受容体とのこの相互作用は、しかしながら、アリピプラゾールの作用のメカニズムは安定ドパミン - セロトニンシステムとして指定することができる、セロトニンおよびドーパミンシステムのバランス機能を一般的にもたらすと考えられています。
したがって、神経遮断薬の神経化学的作用機序に関する現在の知見は、この群の向精神薬の病理学的により実証された薬力学的分類を提案することを可能にする。この分類を使用することにより、ある種の薬物の向精神薬活性、忍容性および可能性のある薬物相互作用のスペクトルを大部分予測することが可能になる。言い換えれば、製剤の神経化学的活性の特徴は、特定の患者に対する抗精神病薬の選択を導くべき臨床活性の特徴を主に決定する。
神経遮断薬の任意のグローバル抗精神病効果の有効性は、これはハロペリドール50mgのクロルプロマジンとその抗精神病効力1mgのが同等手段いわゆる等価例えば1としたクロルプロマジン、ハロペリドール、クロルプロマジン当量= 50で評価しました。神経遮断薬の割り当てを提供する開発された、この分類指標に基づいて、ハイ(等価クロルプロマジン> 10.0)を有し、中等度の(等価クロルプロマジン= 1.0~10.0)及び低(等価クロルプロマジン= 1.0)抗精神病活性と呼ばれます特許性。ほぼ半世紀の典型的な抗精神病薬(第一世代抗精神病薬)は、広く臨床薬物療法で使用されています。それらの治療活性のスペクトルは以下を含む:
- 差別的かつ差別的に精神病の様々な兆候を軽減する能力の形態でのグローバルな抗精神病作用:
- 一次鎮静(抑制)作用 - 薬物が精神運動の興奮を速やかに止める能力。
- 選択的で選択的な抗精神病効果であり、個々の症状に影響を及ぼす能力で現れる:せん妄、幻覚、ドライブの脱抑制など。
- 錐体外路症状の発現によって明らかにされる活性化(脱阻害、脱阻害、抗 - 尿毒症)神経栄養作用;
- 神経内分泌および栄養上の副作用の発症の形での運動性行動;
- 一部の抗精神病薬が抑うつ症状を引き起こす能力で表現された抑圧効果。
精神病性障害だけでなく、境界精神医学の枠組みにおける違反の治療における第1世代抗精神病薬の有効性は、繰り返し証明され、否定できない。したがって、処方されたときの治療の副作用の頻度が高いにもかかわらず、それらは医療行為に引き続き使用される。
Atipichnыeantipsihotiki
最新のガイドラインには、第2世代の抗精神病薬を薬物療法に使用することの利点に関するデータが含まれています。用語「非定型」(同義語 - 第2世代の抗精神病薬)は条件付きであり、主に新世代を指定する便宜のために使用します。伝統的な神経弛緩薬と比較したこの群の調製は、忍容性が良好であり、錐体外路症状のリスクが低いという否定的、感情的および認知的障害を改善する上でより効果的である。多数の非定型抗精神病薬からのこの治療法またはその治療薬の治療効果の性質の相違は、典型的な神経遮断薬群のように、個々の薬理作用のプロファイルを説明する。
心理療法の非定型抗精神病薬の可能性を明確にするために、ロシアに登録されたこのグループの準備に留意することが望ましい。
 [39], [40], [41], [42], [43], [44], [45], [46], [47], [48], [49], [50],
[39], [40], [41], [42], [43], [44], [45], [46], [47], [48], [49], [50],
クロザピン(ジゼントジアゼピン)
非定型抗精神病薬群の祖先。クロザピンの作用機序は、5-HT2a受容体、a1、a2-アドレナリン作動性およびH1-ヒスタミン受容体と同時に高い拮抗作用を有するD2受容体のわずかな遮断によって特徴付けられる。それは、他の抗精神病薬(予備群の薬剤)に対する耐性の場合に効果的な抗精神病薬として確立しており、慢性躁病、精神病性激越、攻撃性の治療にも適応されている。国内では、クロザピンはしばしば鎮静を達成するために処方され、精神病患者では催眠薬として処方される。このようなクロザピンの使用は、治療における使用の適応症の主なプロファイルに対応していないことを認識すべきである。おそらく、二次的に重要な準備としてのこの抗精神病薬に対する態度は、抵抗性患者において実証された有効性を有する唯一の治療薬であるため、再考すべきであろう。
クロザピンは、典型的な神経弛緩薬とは対照的に、02受容体について上記した低親和性のために重篤なエストラスタミド障害を引き起こさない。また、遅発性ジストニアや重度の定位障害の治療にも使用できることが判明しました。ZNSを発症するリスクが小さいことから、クロザピンは、以前にこの合併症に罹患していた患者の中から選択される薬剤と考えることができる。
それにもかかわらず、クロザピン治療では、多くの重篤な副作用が発現する可能性がある。それらの中で最も危険なのは(小用量の投与でも)無顆粒球症であり、これは患者の0.5〜1.0%で起こる。薬物の使用により可能な他の重要な副作用の中には、以前の抗精神病薬療法の影響下でクロザピンの任命時までにしばしば増加する眠気、過覚醒および体重増加が注目されるべきである。それはまた、頻脈、動脈低血圧およびてんかん発作の摂取を伴って発達する可能性に注意を払うべきである。発作の発生の可能性は用量に依存する。クロザピンの投与量が600mg /日を超えると、そのリスクは有意に増加する。発作の発症は、薬物のさらなる投与のための禁忌ではないが、半減薬の減少およびバルプロ酸などの抗けいれん剤の投与が必要である。クロザピン治療の副作用の予防には、白血球像、ならびにECGおよび内分泌パラメータの注意深い監視が含まれる。
昏睡の開発、および抗コリン作用(頻脈、せん妄)、痙攣、呼吸抑制、錐体外路症候群に関連する症状まで意識の過剰クロザピン可能うつ病に。2500 mgを超える用量を服用すると致命的な結果が生じることがあります。
 [51], [52], [53], [54], [55], [56], [57], [58], [59], [60], [61], [62], [63], [64], [65], [66]
[51], [52], [53], [54], [55], [56], [57], [58], [59], [60], [61], [62], [63], [64], [65], [66]
リスペリドン
セロトニンおよびドーパミンD受容体に対して高い親和性を有するベンズイソオキサゾール誘導体であって、セロトニン系に優勢な効果を有する。この薬剤は、救済増悪、抗再発治療、第1精神病エピソードの治療、統合失調症の陰性症状の矯正を含む広範な使用適応症を有する。精神分裂病患者の認知機能を改善する薬剤の能力が注目される。リスペリドンは、統合失調症患者の併存感情症状も減少させ、双極性情動障害の治療において選択される薬物である可能性があるという予備データが得られている。
リスペリドン療法の副作用、特に錐体外路障害は用量依存性であり、6mg /日を超える用量でより頻繁に生じる。他の副作用には、悪心、嘔吐、不安、眠気、血清プロラクチンレベルの上昇が含まれる。リスペリドンの長期使用は、体重の増加および2型糖尿病の発症につながる可能性がありますが、クロザピン、オランザピンよりはそうではありません。
過剰摂取、傾眠、てんかん発作、QT間隔の延長およびQRS複合体の拡張の場合、動脈低血圧が可能である。リスペリドンの過剰摂取の場合の致命的転帰のケースが記載されている。
薬物の疑いのない利点 - 液体および急速に溶解する(舌下の)形態の存在。患者の体内で薬物の受容を促進し、その摂取量の制御を容易にする。また、薬物の長期間の形態 - 筋肉内注射のための懸濁液の調製のための粉末(マイクロスフェア中のコンファペピペリドン)がある。精神分裂病患者の支持療法、特に服薬遵守の悪い患者のために推奨される。考慮に入れ、血流に薬剤を取得するためにさらに最初の注射後少なくとも3週間経口リスペリドンの形を取る必要があり、治療CONSTA-リスペリドン患者の最初にして、約3週間を要しているという事実を取ることが必要です。
オランザピン
Pleyomorfnym受容体プロファイルとクロザピンと同様の薬理作用によりセロトニン、ムスカリン、A1アドレナリン、ヒスタミン受容体に対して有意な親和性を有します。オランザピンの治療活性は、統合失調症の陽性、陰性および抑うつ症状に影響を及ぼすクロザピンおよびリスペリドンの有効性と類似している。同時に、第1の精神病エピソードを有する患者における他の非定型抗精神病薬と比較して、認知能力の矯正において、オランザピンの有効性がより高いことに関するデータが得られた。薬物の錠剤形態の使用による治療の開始時に、精神運動の興奮および不安の増大を伴う減退作用の急速な出現が可能であることを念頭に置くべきである。したがって、重度の精神運動を伴った発作の治療において、薬物の注射形態の使用が示される。
オランザピンは稀に錐体外路障害または遅発性ジスキネジーを引き起こし、使用されるときの最も一般的な副作用は代謝障害および体重増加である。ことが分かったオランザピン頻繁コレステロールレベル、血漿脂質の増加及び2型糖尿病の素因があるが、同様の効果は、オランザピン及びクロザピンで治療された患者に等しい頻度で起こる受けている患者です。しかし、体重増加得られたデータ(すなわち、治療の重要な予測因子として働く)オランザピンの受信に肯定応答と相関し、肥満になる - に過体重獲得した患者のわずか20〜30%治療。
過剰摂取の場合、鎮静効果、毒性コリン分解作用、てんかん発作、動脈低血圧が可能である。現在までに、この薬剤の過剰摂取による死亡リスクを評価する説得力のある証拠はない。
クエチアピン
ジベンゾチアゼピン化合物を参照してください。その受容体プロファイルは、多くの点でクロザピンのものと同様である。クエチアピンのD2レセプターへの結合レベルは、高用量を使用しても低い(50%未満)短期間である。この薬物は、統合失調症の陽性、陰性および一般的症状の治療に有効である。そこ療法に対する高い抵抗性の場合は、そのアプリケーションの成功の証拠であり、統合失調症の維持療法の第一選択抗精神病薬として、それをお勧めする権利を与えている患者の認知機能のパフォーマンスを向上させることができます。最後に、クエチアピンは適度に抗うつ作用、活性化作用を有する。したがって、それは、うっ血性妄想発作およびセネスト - 錐体球系の障害の治療において示される。
クエチアピンの確立された高い胸腺刺激活性は、抑鬱障害の緩和および二次予防のための治療薬として登録されているという事実を説明している。タイプIおよびIIの双極性障害の枠組み内の躁病エピソードの治療のために、クエチアピンがさらなる薬剤として使用される。注射の欠如は、興奮と攻撃的行動を有する患者における使用を幾分制限する。
クエチアピンはかなり良好な耐性を有し、最大用量を使用する場合を除いて、事実上錐体外路症候群を引き起こさない。クエチアピンは、オランザピンおよびクロザピンよりも頻繁に過プロラクチン血症を引き起こさず、体重の増加および耐糖能障害をもたらす。
ジプラシドン
受容体活性の独特のプロファイルを有する。5HT2a受容体およびD2受容体の強力なアンタゴニストであることから、セロトニンおよびノルエピネフリンの再取り込みの活性阻害剤でもある。臨床試験では、ハロペリドールと比較してジプラシドンが精神病の症状および攻撃性の発現に及ぼす有意な優越性が証明されている。また、ジプラシドンが精神分裂病患者の認知機能に及ぼす正の効果、ならびに併存する情動症状についてのデータが、社会的機能の指標として得られた。ジプラシドンは通常、耐容性が高く、錐体外路症候群、体重増加および代謝障害を引き起こすことはまれである。多くの場合、QT間隔が460msを超えて延長されているため、この薬剤を受けている患者さんは、薬剤の予約前にECG検査を行い、治療中のモニタリングを監視することをお勧めします。QT間隔の延長を悪化させ、心不整脈、心室細動を引き起こす可能性のある併用療法(抗不整脈薬)には、特別の注意が払われるべきである。
Sertindol
フェニルインドールの誘導体を参照のこと。これは、D2-、セロトニン(特に5-HT2a受容体)およびα1-アドレナリン受容体に関して高い機能的拮抗作用を有する。電気陰性化学的研究によれば、セルトインドールは腹側部分領域のドーパミン受容体を選択的に阻害する。この選択性は、すべての確率で、薬物が使用される場合の錐体外路症候群および高プロラクチン血症のリスクが低い。比較研究の結果、セルトインドールは、抗精神病活性に関してハロペリドールに匹敵することが示されている。この薬は、rispoleptの同様の効果を上回る、陰性およびうつ症状を有する患者において顕著な抑制抑制効果を有する。統合失調症患者の認知障害の矯正のためのセルトンドールの有効性を確認するデータもある。Sertindoleは、原則として、患者によく耐容され、まれに鎮静を引き起こすため、他の現代の抗精神病薬による治療中の副作用の発生の代替薬として推奨されています。
深刻な副作用の中にQ-Tの間隔を延長する薬剤の能力が注目され、心臓不整脈を引き起こす可能性がある。市販後の研究を分析すると、セルトールドールの心臓学的プロファイルは新世代の他の抗精神病薬のそれと変わらないことが明らかになった。
アリピプラゾール
他の非定型抗精神病薬と同等であるが、精神分裂病患者の認知機能のパラメーターに大きな影響を及ぼす。上記のD2レセプターの部分アゴニストである薬物の独特の薬理学的作用は、錐体外路症候群および高プロラクチン血症のリスクを低減することを可能にする。
 [67], [68], [69], [70], [71], [72], [73], [74], [75], [76]
[67], [68], [69], [70], [71], [72], [73], [74], [75], [76]
アミスルプリド
それらは、置換されたベンズアミドのクラスを指す。薬物はD2-及びD3-ドーパミン作動性受容体のサブタイプD1-、D4-とD5-、ならびにセロトニン、ヒスタミンH1、およびアドレナリンA1-コリン作動性受容体に対する親和性を有していないサブタイプに選択的に結合します。高用量で使用すると、シナプス後D2受容体を遮断する。低用量では、シナプス前D2-の遮断に起因dezingibiruyuschy効果が現れるD3受容体、それがされているが故にその使用は、また、陰性症状の治療に有効である - D2受容体アンタゴニストおよびセロトニン受容体結合していません。多くの研究の結果は、従来の薬物より優れた高用量を使用した場合、その薬物の顕著な抗精神病活性を示す。
 [77], [78], [79], [80], [81], [82], [83], [84], [85], [86], [87]
[77], [78], [79], [80], [81], [82], [83], [84], [85], [86], [87]
抗精神病治療の副作用
この表は、非定型抗精神病薬による治療の主な副作用を示しています。
|
薬 |
錐体外路 |
ECGの伝導性障害 |
代謝障害(体重増加、血中のグルコース、コレステロール、トリグリセリドの増加) |
||
|
クロザピン |
。 |
++ |
++ |
++ - |
|
|
リスペリドン |
++ |
+/- |
++ |
+/- |
|
|
オランザピン |
+ |
+/- |
+++ |
++ |
+++ |
|
クエチアピン |
+/- |
+ |
+/- |
--- |
|
|
ジプラシドン |
+ |
++ |
+/- |
+/- |
+/- |
|
Sertindol |
++ |
- |
+/- |
- |
|
|
アリリプラゾール |
- |
--- |
+/- |
- |
- |
|
アミスルプリド |
++ |
+/- |
|||
注意:副作用の重大度: "+++" - 高: "++" - 中程度; "+" - 低; "+/-" - 疑わしい。" - " - は存在しません。
錐体外路症候群
従来の抗精神病薬の主な特徴の1つは、錐体外路症候群を引き起こす能力が低いことであり、統合失調症の薬物療法を支援する画期的なものでした。しかし、表のデータから以下のように、このシリーズのいくつかの薬剤(リスペリドン、アミスルプリド)を使用する場合、そのような症状が起こり得る。
 [5], [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16], [17]
[5], [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16], [17]
心電図障害
現代の抗精神病薬を治療に用いる場合、心臓の副作用を発症する可能性は深刻な問題である。これらの場合、Q-T間隔の延長であり、不整脈を引き起こす可能性がある。導電破壊、特にQ-T間隔の延長は、クロザピン、セルチンドール、ジプラシドンで最もよく観察される。徐脈、房室遮断、甲状腺機能低下症の形での併存病変は、上記薬物の治療におけるこの合併症の発生に寄与し得る。現在、非定型抗精神病薬による維持療法を受けている患者では、約3ヶ月ごとにECGモニタリングが推奨されています。
 [18], [19], [20], [21], [22], [23]
[18], [19], [20], [21], [22], [23]
内分泌障害
現在のところ、最大の問題は、体重増加を引き起こす非定型抗精神病薬の能力である。血液中の体重、グルコース、トリグリセリドの増加は、代謝障害および2型糖尿病の発症につながり得る。特に、クロザピンとオランザピンによる治療中の生化学的パラメータの慎重かつ毎週のモニタリングが必要である。J. Geddes et al。(2000)、R.V. ジョーンズ、PFバックリー(2006)代謝異常は前に家族歴、太りすぎ、脂質スペクトルと高血糖を持っていた患者ではより一般的であることが知られているので、特定の抗精神病薬、現代の世代にそれらを処方する前に、患者の徹底的な検査を実施することをお勧め認識されるべきです治療。P.V.Jones、PF Buckley(2006)が提案した監視アルゴリズムには、いくつかの項目が含まれています。
- 代謝障害のリスクに関する痴呆および家族要因の収集
- 治療前の体格指数、ECG、血圧および脈拍の登録。
- 治療開始前の検査データ(グルコース、脂質スペクトル、コレステロール)の収集。
- 治療中のバイタルサイン、体格指数の定期的モニタリング。
- 治療中の検査データの管理。
抗精神病治療における高プロラクチン血症の出現は、視床下部におけるドーパミン受容体の中枢遮断により、下垂体の前葉におけるプロラクチンの放出をもたらす。最も一般的な過プロラクチン血症は、オランザピン、リスペリドン、アミスルプリドで治療した場合に発生します。
無顆粒球症
抗精神病治療のもう一つの重大な合併症。クロザピンとオランザピンで観察することができます。J. Geddes et al。(2000年)、彼はこれらの薬剤を服用している患者の1〜2%で最初の3ヶ月間に診断された。この点に関して、治療の最初の18週間にこれらの薬物を服用している患者、および将来的に毎月のモニタリングで、毎週の血液検査を推奨する。上記の神経遮断薬の投与量が減少すると、臨床血液検査は再び正常に戻ったことが示された。同時に、代謝障害に付随する副作用を経験する患者には、現在のところ明確な戦略がないことが認識されるべきである。ほとんどの場合、非定型抗精神病薬を別の非定型抗精神病薬に置き換えます。別の有望な分野は、特に高プロラクチン血症の矯正のための薬剤ブロモクリプチンの使用、特別な矯正療法の任命であるべきである。理想的には、このような障害を有する患者が、内科医、特に内分泌学者、心臓病学者および他の専門家の定期的な関与を受けて治癒される状況と考えるべきである。
結論として、患者の精神だけでなく身体状態の任命および監視のための上記のアルゴリズムに従って、第2世代の薬物は典型的な神経遮断薬よりも安全であることに留意すべきである。
現在、多数の抗精神病薬が開発されている。次世代の準備は、異なる作用機序(例えば、GABA-ergic profile)を有する可能性が高く、実際の欠乏障害を含む統合失調症の様々な兆候に影響を与えることができる。
注意!
情報の認識を簡素化するため、この薬物の使用説明書は、薬物の医療使用に関する公式の指示に基づいて特殊な形で翻訳され提示されています。抗精神病薬、または抗精神病薬
説明は情報提供の目的で提供され、自己治癒の手引きではありません。 この薬物の必要性、治療レジメンの目的、薬物の投与方法および投与量は主治医によってのみ決定される。 自己投薬はあなたの健康にとって危険です。


