習慣性流産 - 原因
記事の医療専門家
最後に見直したもの: 04.07.2025
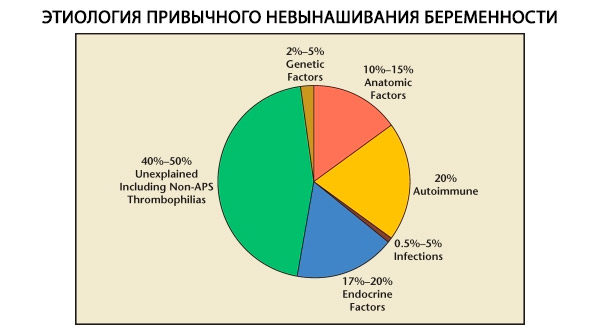
習慣性流産の構造においては、遺伝的要因、解剖学的要因、内分泌学的要因、免疫学的要因、感染性要因が区別されます。これらの要因をすべて除外した場合でも、習慣性流産の原因が不明な患者群(特発性流産)が残ります。C. Coulamら(1996)によると、特発性流産の80%は、認識されていない免疫疾患が原因です。
子宮内膜症が流産の再発を引き起こす、あるいは子宮内膜症の薬物治療や外科的治療が流産の再発率を低下させるという説得力のある証拠はありません。
現在の概念によれば、異常胚の形成につながる遺伝的および部分的な感染性要因に加えて、他の要因(解剖学的、内分泌学的、免疫学的)の有害な影響の発現は、遺伝的に完全な受精卵の発育にとって不利な環境を作り出し、絨毛膜の予備容量の枯渇と発育(胚形成)の停止につながると考えられています。妊娠初期の臨界期は、6~8週(胚の死滅)と10~12週(受精卵の排出)とされています。
 [ 1 ]
[ 1 ]
習慣性流産の遺伝的原因
遺伝的要因は、習慣性流産の原因の3~6%を占めます。妊娠初期の散発性中絶では、約50%に染色体異常が認められます。そのほとんど(95%)は染色体数の変化であり、モノソミー(染色体が1本失われる)やトリソミー(染色体が1本増える)は減数分裂のエラーによるもので、倍数性(染色体構成が半数体セット全体から増加する)は卵子が2つ以上の精子によって受精した際に発生します。散発性流産では、トリソミーが最も多く発生し、全変異の 60% を占めます (最も多いのは染色体 16、13、18、21、22)。次に多いのはシェレシェフスキー・ターナー症候群 (染色体 45 X0) で、20% を占めます。残りの 15% は倍数性 (特に三倍性) によるものです。
流産における染色体数の変化の場合、両親の核型検査ではほとんどの場合病理は明らかにならず、その後の妊娠中に胎児に染色体疾患が発生する確率は1%です。一方、習慣性流産のカップルの流産を検査すると、3~6%の症例で染色体構造の変化(染色体内および染色体間)が観察されます。両親の核型を検査すると、7%の症例で均衡のとれた染色体再編成が見つかります。ほとんどの場合、これらは相互転座であり、1つの染色体の一部が非相同染色体の別の部分の代わりに位置しているだけでなく、性染色体のモザイク、逆位、およびリング状の染色体の検出も含まれます。配偶者の一方にこのような転座が存在する場合、減数分裂中の染色体の対合および分離のプロセスが阻害され、配偶子における染色体部分の喪失(欠失)または重複(重複)が生じます。これはいわゆる不均衡染色体転座を引き起こし、その場合、胚は生存不能となるか、重度の染色体異常の保因者となります。両親の一方に均衡染色体転座が存在する場合、不均衡染色体異常を持つ子供が生まれる確率は1~15%です。データの違いは、転座の性質、関与する部分のサイズ、保因者の性別、および家族歴に関連しています。
診断
病歴
- 家族内の遺伝性疾患。
- 家族内に先天異常がある。
- 知的障害のある子どもの誕生。
- 夫婦または親族に原因不明の不妊症および/または流産がある場合。
- 周産期死亡率が不明な症例の存在。
特別な研究方法
- 両親の核型の検査は、流産歴に加えて発達障害のある新生児が生まれた夫婦や、妊娠初期の習慣性流産の場合に特に適応されます。
- 死産または新生児死亡の場合の流産の細胞遺伝学的分析。
他の専門医に相談する適応
両親の核型の変化が検出された場合は、遺伝学者に相談して、病理学上の問題を抱えた子どもが生まれるリスクの程度を評価したり、必要に応じて卵子や精子の提供について決定したりする必要があります。
患者のさらなる管理
夫婦のどちらかの親にさえ病的な核型がある場合は、胎児の発達障害のリスクが高いため、妊娠中に出生前診断(絨毛膜生検または羊水穿刺)を行うことが推奨されます。
習慣性流産の解剖学的原因
習慣性流産の解剖学的原因には以下のものがあります:
- 子宮の発育における先天異常(子宮が完全に重複している、双角子宮、鞍型子宮、単角子宮、部分的または完全な子宮中隔)
- 後天的な解剖学的欠陥;
- 子宮内癒着(アッシャーマン症候群)
- 粘膜下子宮筋腫;
- 峡部頸椎不全症。
習慣性流産患者における解剖学的異常の発生頻度は10~16%です。流産(不妊症ではない)につながる可能性のある子宮奇形の発生頻度は、全子宮奇形と比較して、双角子宮(37%)、鞍型子宮(15%)、子宮中隔(22%)、子宮の完全重複(11%)、単角子宮(4.4%)となっています。
習慣性流産の診断
病歴
子宮の解剖学的病理の場合、妊娠の遅延中絶や早産がよく見られますが、子宮中隔または筋腫リンパ節付近への着床の場合は妊娠の早期中絶も考えられます。
峡部頸管無力症の特徴的な兆候は、妊娠中期の自然流産または早期早産であり、これらは比較的速やかに、ほとんど痛みもなく起こります。
子宮奇形の場合、尿路病変の既往歴(子宮の先天異常を伴うことが多い)と月経機能の発達の性質(機能する子宮原始角を伴う血子宮腫の兆候)に注意を払う必要があります。
特別な検査方法
- 現在、子宮卵管造影検査は診断を確定するために行われ、子宮腔の形状の観察、粘膜下筋腫、癒着、隔壁の存在の確認、卵管の開存性の判定を可能にします。子宮病変の診断には、月経と排卵の間、つまり出血が止まった後の月経周期の第一期(周期7~9日目)に子宮卵管造影検査を行うのが合理的です。子宮頸管狭窄症の診断には、月経周期の第二期(18~20日目)に検査を行い、子宮頸管の内口の状態を確認します。子宮卵管造影検査を行う前に、骨盤内臓器の炎症性疾患を除外するか、治療する必要があります。
- 近年、子宮鏡検査は広く普及し、子宮内病変の診断におけるゴールドスタンダードとなっています。しかし、子宮卵管造影検査に比べて費用が高いため、この方法は、予備的な超音波検査データに基づいて子宮内病変の兆候が示された女性に用いられます。子宮鏡検査は、子宮腔の検査、子宮内病変の性質の判定、そして必要な器具(切除鏡)が利用可能な場合は、癒着、粘膜下筋腫リンパ節、子宮内膜ポリープの除去といった低侵襲外科治療を行うために用いられます。子宮中隔の除去には、子宮壁の穿孔の可能性を防ぐため、腹腔鏡操作による子宮切除鏡検査が優先されます。
- 超音波検査は月経周期の前半に実施され、粘膜下子宮筋腫や子宮内癒着の暫定診断を可能にします。また、月経周期の後半には、子宮中隔や双角子宮を特定するために超音波検査が行われます。この検査法は妊娠初期に特に重要であり、これらの疾患の診断感度は100%、特異度は80%です。妊娠初期以外では、他の検査法による追加的な確認が必要です。
- 海外の研究者は、子宮卵管造影法(子宮腔内に0.9%塩化ナトリウム溶液を予め注入し、経膣センサーを用いて超音波検査を行う方法)よりもソノヒステログラフィーが優れている点を指摘しています。これは、子宮中隔と双角子宮の鑑別診断が可能となるためです。ソノヒステログラフィーでは、子宮腔の形状を検査できるだけでなく、子宮底の形状も判定できます。しかし、我が国では、この方法はまだ普及していません。
- 複雑な症例では、骨盤内臓器の MRI を使用して診断を検証することもあります。この方法により、骨盤内臓器の非典型的な配置を伴う子宮発育異常の場合に貴重な情報を得ることができます。 MRI は、原始子宮角がある場合、それを除去するのが適切かどうかを判断するために重要です。原始子宮角を除去する必要があるのは、それが卵管や卵巣とつながっていて、その中で受精卵の形成と発育を妨げている場合です。子宮の解剖学的異常がある場合の妊娠中絶は、受精卵の着床不全 (子宮中隔、粘膜下筋腫リンパ節付近)、血管新生と子宮内膜の受容の不十分な発達、子宮腔内の密接な空間関係 (たとえば、筋腫リンパ節による腔の変形の場合)、ICI を伴うことが多いこと、およびホルモン障害に関連している可能性があります。
習慣性流産の治療
外科的治療
子宮中隔、粘膜下筋腫リンパ節、癒着がある場合、最も効果的な外科的治療は子宮切除鏡検査です。この群の女性における術後流産率は、術前90%に対して10%に低下しました。P. Heinonen (1997) は、開腹手術による子宮形成術と経頸管子宮切除鏡検査による子宮形成術の結果を比較したところ、子宮切除鏡検査の方が外傷が少なく、有効性が高いという結果を得ました。生存児出産率はそれぞれ68%と86%でした。
子宮中隔、癒着、粘膜下筋腫リンパ節の外科的切除により、流産の70~80%は回避できます。しかし、子宮奇形を有し、正常分娩後に流産を繰り返す女性では効果がありません。このような症例では、解剖学的要因が主な原因ではない可能性が高いため、他の流産原因を探す必要があります。
腹腔鏡下子宮形成術は術後不妊症の重大なリスクを伴い、その後の妊娠の予後を改善することはないことが証明されています。したがって、子宮鏡手術や腹腔鏡手術を優先することが望ましいでしょう。
薬物治療
子宮内避妊器具(IUD)、高用量のエストロゲン薬、癒着除去術後の子宮腔内へのフォーリーカテーテル挿入、子宮内膜中隔除去術の有効性は証明されていません。術後3ヶ月以上経過してから妊娠を計画することをお勧めします。子宮内膜の成長を促進するために、3月経周期にわたって周期的なホルモン療法を実施します[14]。3ヶ月間、周期の最初の14日間に17-β-エストラジオール2mgを含む薬を服用し、次の14日間に17-β-エストラジオール2mgとジドロゲステロン20mg(併用薬の一部としてジドロゲステロン10mgと、別の錠剤の形でジドロゲステロン10mg)を服用することをお勧めします。
患者のさらなる管理
双角子宮または子宮重複(子宮腔が2つある場合)の妊娠経過の特徴:
- 妊娠初期には、顕著な脱落膜反応により、「空の」角または子宮腔から出血が起こることがよくあります。この場合の戦略は保守的であり、鎮痙剤と止血剤を使用する必要があります。
- さまざまな段階での妊娠中絶の脅迫。
- 峡部頸部不全の発症;
- 胎盤機能不全による子宮内発育遅延。
妊娠初期に出血があった場合、安静または半安静が推奨され、止血薬、鎮痙薬、鎮静薬の投与、および妊娠16~18週までのゲスタゲン(1日20~40 mgのジドロゲステロン)による治療が推奨されます。
習慣性流産の内分泌的原因
様々な研究者によると、流産の内分泌的原因は8~20%を占めています。その中で最も顕著なものは、黄体期欠乏症(LPD)、黄体形成ホルモン(LH)の過剰分泌、甲状腺機能不全、糖尿病です。
重度の甲状腺疾患や糖尿病は、流産を繰り返す原因となる可能性があります。しかし、代償性糖尿病の場合、習慣性流産のリスクは一般集団と変わりません。
同時に、人口における甲状腺機能低下症の発生率が高いため、TSH値の測定によるスクリーニングが必要です。習慣性流産患者では、黄体機能不全が症例の20~60%に認められ、多嚢胞性卵巣の超音波所見が44~56%に認められます。文献によると、個々のホルモン障害が習慣性流産の症状群の形成に及ぼす影響については、依然として議論の的となっています。M. Ogasawaraら(1997)の研究では、自己免疫性、解剖学的、感染性の原因を除き、既往歴に2回以上の流産歴がある患者において、LPIの有無による妊娠中絶頻度に信頼できる差は認められませんでした。
黄体機能不全は、いくつかの不利な要因の結果として起こる可能性があります。
- 月経周期の第一期におけるFSHおよびLH分泌の障害。
- LH 放出のピークが早すぎる、または逆に遅すぎる;
- 卵胞形成不全に起因する低エストロゲン血症。これらの症状はいずれも、排卵後期における黄体ホルモン補充療法では改善できません。L. Reganらによる前向き研究では、月経周期8日目に黄体形成ホルモン(LH)過剰分泌を示す患者は、血中LH濃度が正常な女性と比較して、流産頻度が有意に増加することが示されました(それぞれ65%と12%)。時期尚早なLH急増の悪影響は、第二減数分裂の早期再開と未熟卵子の排卵、そして黄体形成不全の影響下での莢膜細胞によるアンドロゲン産生の誘導、ならびに子宮内膜受容障害に関連しています。しかし、その後の妊娠期間を延長することを目的とした追加措置を講じずに、排卵前LHレベルをゴナドトロピン放出ホルモン作動薬で予備的に低下させた場合、流産頻度は期待どおりに低下しません。
NLF を診断するためのゴールドスタンダードは、2 つの月経周期にわたる周期の第 2 期の子宮内膜生検から得られた材料の組織学的検査です。
高プロラクチン血症、甲状腺機能低下症、アンドロゲン(卵巣または副腎)の機能的過剰など、排卵障害の他の原因の診断には、適切な治療の処方が伴わなければなりません。
診断
病歴と身体検査
- 既往歴。考慮すべき要因:初経の遅れ、月経周期の不規則性(稀発月経、無月経、急激な体重増加、体重減少、不妊症、習慣的な早期流産)。
- 検査: 体型、身長、体重、多毛症、二次性徴の重症度、線条の存在、乳腺の乳汁漏出の検査。
- 機能診断検査:3回の月経周期中の直腸温度の測定。
特別な研究方法
- ホルモン研究:
- 月経周期の第 1 期(7~8 日目)- FSH、LH、プロラクチン、TSH、テストステロン、17-ヒドロキシプロゲステロン(17-OP)、DHEAS の含有量の測定。
- 月経周期の第2期(21~22日) – プロゲステロン含有量の測定(プロゲステロンレベルの標準指標は非常に変動しやすいため、他の要因を考慮せずにこの方法を使用することはできません)。
- 超音波:
- 月経周期の第 1 期(5~7 日目)-子宮内膜病変、多嚢胞性卵巣の診断。
- 月経周期の第2期(20~21日)に子宮内膜の厚さを測定します(正常範囲は10~11mm、プロゲステロンの含有量と相関します)。
- NLFを確認するための子宮内膜生検は、月経予定日の2日前(28日周期の場合は26日目)に行われます。この方法は、診断が不明確な場合に用いられます。いわゆる「着床期」における子宮内膜の変化を調べるために、排卵後6日目に生検が行われます。
処理
NLF(直腸温度チャートによると、第2段階の持続期間は11日未満、温度の段階的な上昇が観察される、子宮内膜生検データによると子宮内膜の分泌変換が不十分、血清中のプロゲステロンレベルが低い)を診断する場合、そのような障害の原因を特定する必要があります。
NLFが高プロラクチン血症を伴う場合は、脳MRI検査が行われます。代替方法としては、頭蓋骨(トルコ鞍部)のX線検査があります。
高プロラクチン血症の第一段階は、外科的治療を必要とする下垂体腺腫を除外することです。有意な変化がない場合、高プロラクチン血症は機能性とみなされ、プロラクチン値を正常化するためにブロモクリプチン治療が処方されます。ブロモクリプチンの初期投与量は1.25 mg/日で、2週間投与します。プロラクチン値をモニタリングした後、指標が正常化しない場合は、2.5 mg/日に増量します。プロラクチン値が著しく上昇した場合は、初期投与量を2.5 mg/日に増量します。妊娠した場合は、ブロモクリプチンの投与を中止する必要があります。
甲状腺機能低下症が検出された場合、内分泌専門医と連携して甲状腺病変の性質を特定します。いずれの場合も、レボチロキシンナトリウムの連日投与が適応となり、TSH値が正常化するまで個別に用量を決定します。妊娠した場合は、レボチロキシンナトリウム投与を継続する必要があります。妊娠初期における用量増加の可否については、ホルモン検査(TSH値、遊離チロキシン)の結果に基づき、内分泌専門医と連携して判断します。
NLFの改善は2つの方法のいずれかで行われます。1つ目は排卵刺激療法、2つ目はプロゲステロン製剤による補充療法です。
最初の治療法は、クロミフェンシクエン酸塩による排卵誘発です。この治療法は、黄体期障害のほとんどが卵胞期に発生するという事実に基づいています。第2期におけるプロゲステロン値の持続的な低下は、第1期における卵胞形成の障害の結果です。この障害は、第2期にプロゲステロンを処方するよりも、卵胞期初期に低用量のクロミフェンシクエン酸塩を投与する方が、より効果的に改善されます。
1周期目では、クロミフェンシクエン酸塩を月経周期の5日目から9日目まで1日50mg投与します。効果は、直腸温、月経周期第2期におけるプロゲステロン濃度測定、または動態超音波検査を用いてモニタリングします。2周期目の排卵刺激で十分な効果が得られない場合は、5日目から9日目まで1日100mgに増量します。3周期目の排卵刺激では、最大1日150mgまで投与可能です。このような増量は、薬剤の忍容性が良好である(下腹部および腰部に激しい痛みがなく、その他の卵巣過剰刺激の兆候がない)場合にのみ可能です。
2番目の治療法は、プロゲステロン製剤による補充療法です。これは子宮内膜の完全な分泌転換を促進し、排卵が維持された習慣性流産の患者に必要な効果をもたらします。さらに、近年、プロゲステロン製剤の投与はホルモン効果だけでなく免疫調節効果もあり、子宮内膜の免疫担当細胞からの拒絶反応を抑制することが確立されています。特に、20 mg /日の用量のジヒドロゲステロンで同様の効果が報告されています。補充療法の目的で、ジドロゲステロンは経口で20 mg /日の用量で、または微粉化プロゲステロンは膣で200 mg /日の用量で使用されます。治療は排卵後2日目(直腸温度の上昇の翌日)に行われ、10日間続きます。妊娠した場合は、プロゲステロン製剤による治療を継続する必要があります。
現代の研究では、反復流産の治療におけるヒト絨毛性ゴナドトロピンの有効性は確認されていません。
習慣性流産患者における高アンドロゲン血症(卵巣性または副腎性)では、アンドロゲンが排卵の完全性と子宮内膜の状態に影響を与えるため、薬物療法が適応となります。副腎アンドロゲンの生合成に障害がある場合、女性胎児に対する男性化作用が生じる可能性があるため、胎児の利益のためにステロイド療法が行われます。
卵巣発生時の高アンドロゲン血症(多嚢胞性卵巣)
病歴、身体検査および特別検査結果
- 既往歴:初経が遅れている、稀発月経などの月経周期異常(通常は原発性、まれに続発性)。妊娠は稀で、通常は妊娠初期に自然に中断し、妊娠と妊娠の間には長期間の不妊期間がある。
- 検査: 多毛症、ニキビ、ストレッチマーク、高BMI(オプション)。
- 直腸温度チャート: 無排卵周期と排卵およびNLF周期が交互に現れます。
- ホルモン検査:テストステロン値が高く、FSH および LH 値が上昇している可能性があり、LH/FSH 比が 3 を超えています。超音波検査:多嚢胞性卵巣。
処理
非薬物治療
減量 - ダイエット療法、身体活動。
薬物治療
- オルリスタット120mgを毎食後に服用します。服用期間は、効果と忍容性を考慮して決定されます。
- 3 回の月経周期にわたって、シプロテロン酢酸塩 (2 mg) と EE (35 mcg) を含む製剤を使用して予備的にテストステロンを減少させます。
- 避妊薬の中止、月経周期第2期のホルモン補充(ゲスターゲン療法) - 月経周期16日目から25日目まで、ジドロゲステロンを1日20mg投与します。自然排卵が見られない場合は、次の段階に進みます。
- 月経周期の5日目から9日目まで、クエン酸クロミフェンを初期用量50 mg/日で投与して排卵を刺激し、同時にゲスタゲン(月経周期の16日目から25日目まで、ジドロゲステロンを用量20 mg/日)およびデキサメタゾン(0.5 mg)を投与する療法。
- 妊娠しない場合は、クロミフェンシクレートの用量を100~150mg/日に増量し、周期の第2期にゲスターゲンを投与し、デキサメタゾン(0.5mg)を併用します。デキサメタゾンは副腎アンドロゲン濃度を低下させるだけですが、クロミフェンシクレートとデキサメタゾンを併用した場合、クロミフェンシクレート単独投与と比較して排卵および妊娠の頻度が有意に高まることが確立されています[12]。
- 排卵刺激を 3 周期実施した後、黄体ホルモン補充療法による 3 周期の月経休止と、腹腔鏡によるアクセス (卵巣の楔状切除、レーザー蒸発術) を使用した外科的治療の決定が推奨されます。
患者のさらなる管理
妊娠管理には、妊娠16週まで黄体ホルモン補充療法(ジドロゲステロン20mg/日またはマイクロナイズドプロゲステロン200mg/日)を併用する必要があります。デキサメタゾンは妊娠初期にのみ処方されます。頸管無力症の早期診断、および必要に応じて外科的治療を行うために、モニタリングは必須です。
副腎性アンドロゲン過剰症(思春期および思春期後副腎性器症候群)
副腎性器症候群(AGS)は、副腎皮質における複数の酵素系の合成を担う遺伝子の損傷により、ホルモン合成が阻害される遺伝性疾患です。この疾患は常染色体劣性遺伝形式で、両親ともに健康な保因者であり、変異遺伝子が受け継がれます。
症例の 90% において、副腎性器症候群は CYP21B 遺伝子の変異によって引き起こされ、21-ヒドロキシラーゼの合成が阻害されます。
病歴、身体検査および特別検査結果
- 病歴: 初潮が遅れている、月経周期がやや長い、稀発月経の可能性、妊娠初期の自然流産、不妊症の可能性。
- 検査: ニキビ、多毛症、アンドロイド体型(広い肩、狭い骨盤)、クリトリス肥大。
- 直腸温度チャート: 無排卵周期と排卵およびNLF周期が交互に現れます。
- ホルモン検査: 17-OP、DHEAS の高レベル。
- 超音波検査:卵巣に変化なし。
妊娠以外での病理学的特徴としては、血漿中の 17-OP 濃度の上昇が挙げられます。
現在、潜在性非典型性副腎性高アンドロゲン症の診断にはACTHを用いた検査が用いられています。この検査には、内因性ACTHの特性を持つ合成ポリペプチドであるSynacthenが用いられます。Synacthenは、副腎におけるコレステロールからのステロイドホルモン合成の初期段階を刺激します。
シナクテン試験(ACTH類似体):シナクテン1ml(0.5mg)を肩に皮下注射し、まず朝9時間後の血漿サンプル中の17-OPとコルチゾール濃度を測定します。注射後9時間で対照血液サンプルを採取し、17-OPとコルチゾール濃度を測定します。判定指数(D)は、以下の式を用いて算出します。
D = 0.052 × 17-OP + 0.005 × コルチゾール/17-OP - 0.018 × コルチゾール/17-OP
D係数が0.069以下の場合、副腎性高アンドロゲン症がないことを示します。D係数が0.069を超える場合、副腎機能不全が原因で高アンドロゲン症が生じていると考えられます。
薬物治療
21-ヒドロキシラーゼ欠損による高アンドロゲン症の治療の中心は、過剰なアンドロゲン分泌を抑制するために使用されるグルココルチコイドです。
患者のさらなる管理
母体アンドロゲンは胎児に男性化作用を及ぼすため、副腎性アンドロゲン過剰症と診断された場合は、妊娠前にデキサメタゾン0.25mgの初期用量を処方し、妊娠期間中は個別に選択した用量(0.5~1mg)で継続します。副腎性アンドロゲン過剰症を伴う習慣性流産の女性の場合、治療を中止することは適切ではありません。治療を行わない場合の流産率は14%に達し、治療を継続した場合は9%に達するためです。
副腎性器症候群の患者は、この遺伝子を胎児に伝える可能性があることを考慮すると、出生前診断を実施する必要があります。妊娠17~18週目に、母親の17-OP含有量を調べるための血液検査が処方されます。血中のホルモン濃度が上昇した場合、羊水中の濃度が測定されます。羊水中の17-OP含有量が上昇した場合、胎児の副腎性器症候群と診断されます。残念ながら、羊水中の17-OP濃度から副腎性器症候群の重症度(軽症型または重症型塩類喪失型)を判断することはできません。このような状況で妊娠を継続するかどうかは、両親が決定します。
子供の父親が副腎性器症候群遺伝子の保因者であり、家族内にこの症候群を持って生まれた子供がいる場合、患者は副腎性アンドロゲン過剰症でなくても、胎児の利益のために(女児の男性化を防ぐため)デキサメタゾンを体重1kgあたり20mcg、最大1.5mg/日の用量で食後に2~3回投与します。17~18週目に胎児の性別と副腎性器症候群遺伝子の発現(羊水穿刺の結果に基づく)を決定した後、胎児が副腎性器症候群の女児であれば、妊娠終了まで治療を継続します。胎児が男児または副腎性器症候群遺伝子の保因者ではない女児の場合、デキサメタゾンの投与を中止できます。
習慣性流産の女性に副腎性高アンドロゲン症がある場合、デキサメタゾン治療は妊娠期間中を通して継続され、出産後にのみ中止されます。出産後3日目から、デキサメタゾンの投与量を徐々に減量し(3日ごとに0.125mgずつ)、産褥期に完全に中止します。
混合起源(卵巣および副腎)の高アンドロゲン血症
病歴、身体検査および特別検査結果
- 既往歴:初経の遅れ、稀発月経(通常は原発性、まれに続発性)、無月経などの月経周期異常、外傷、脳震盪の可能性。妊娠は稀で、通常は妊娠初期に自然中断し、妊娠と妊娠の間には長期間の不妊期間がある。
- 身体検査: 多毛症、ニキビ、線条、黒色表皮腫、高BMI、高血圧。
- 直腸温度チャート: 無排卵周期と排卵およびNLF周期が交互に現れます。
- ホルモン検査: テストステロン値が高い、FSH および LH 値が上昇している、LH/FSH 比が 3 を超える、DHEAS および 17-OP 値が高い、高プロラクチン血症が存在する可能性がある。
- 超音波検査:多嚢胞性卵巣。
- 脳波検査:脳の生体電気活動の変化。
- 高インスリン血症、脂質代謝障害(高コレステロール、低密度リポタンパク質、超低密度リポタンパク質)、耐糖能の低下または血糖値の上昇。
処理
非薬物治療
減量(低カロリーの食事、身体活動)。
薬物治療
第一段階 - インスリン抵抗性がある場合、インスリン感受性を高めるためにメトホルミンを1日1000~1500 mgの用量で処方することが推奨されます。
第 2 段階 - 重度の月経周期障害および高テストステロン レベルの場合、シプロテロン酢酸塩 (2 mg) およびエチニルエストラジオール (35 mcg) を含む抗アンドロゲン作用のある薬を 3 か月間処方することが推奨されます。
3 番目の段階では、排卵を刺激し、その後に黄体ホルモンのサポート (スキームは上記に記載) を行い、デキサメタゾンを 1 日あたり 0.25 ~ 0.5 mg 服用します。
高プロラクチン血症および甲状腺機能低下症の場合は、排卵刺激周期において適切な薬物療法を行う必要があります。妊娠した場合は、ブロモクリプチンの投与を中止し、レボチロキシンの投与を継続する必要があります。
排卵刺激が効果がない場合、直接排卵誘発剤を処方するかどうか、多嚢胞性卵巣の外科的治療または体外受精の適否について決定する必要があります。
患者のさらなる管理
メタボリックシンドロームの患者では、妊娠に伴い高血圧、腎症、凝固亢進が合併することが多く、妊娠初期から血圧や血液凝固図をモニタリングし、必要に応じて降圧薬、抗血小板薬、抗凝固薬を用いてこれらの障害を治療する必要があります。黄体ホルモン薬は妊娠16週まで処方されます。ジドロゲステロンは1日20mg、ミクロ化プロゲステロンは1日200mgを2回に分けて投与します。
高アンドロゲン血症の女性はすべて、子宮頸管閉鎖不全症の発症リスク群に該当します。妊娠16週目から子宮頸部の状態をモニタリングし、必要に応じて子宮頸管閉鎖不全症の外科的治療を行う必要があります。
習慣性流産の免疫学的原因
現在、これまで原因不明であった反復流産症例の約80%(遺伝的、解剖学的、ホルモン的原因を除いた後)は免疫疾患に関連していることが分かっています。自己免疫疾患と同種免疫疾患は区別され、習慣性流産につながります。
自己免疫プロセスでは、免疫システム自身の組織が攻撃の対象となり、つまり免疫反応が自身の抗原に向けられます。このような状況では、母体の組織が損傷を受けることで、胎児は二次的に被害を受けます。
同種免疫疾患では、女性の免疫反応は父親から受け継いだ、母親の体にとっては異物である可能性のある胚/胎児抗原に向けられます。
習慣性流産患者に最も多くみられる自己免疫疾患には、血清中の抗リン脂質抗体、抗甲状腺抗体、抗核抗体の存在が含まれます。妊娠外における習慣性流産女性の31%が、サイログロブリンおよび甲状腺ペルオキシダーゼに対する自己抗体(甲状腺ミクロソーム[甲状腺ペルオキシダーゼ]自己抗体)を保有していることが分かっています。これらの症例では、妊娠初期における自然流産のリスクが20%に上昇します。習慣性流産において、抗核抗体および抗甲状腺抗体の存在は、自己免疫過程を特定し、診断を確定するために更なる検査が必要であることを示しています。
抗リン脂質症候群 (APS) は、胚/胎児の死亡につながる自己免疫疾患として一般的に認識されています。
同種免疫疾患
現在、胎児拒絶につながる同種免疫プロセスには、配偶者の主要組織適合遺伝子複合体システムの共通抗原の数の増加(3つ以上)(血縁結婚でよく見られる)、母親の血清中の阻害因子の低レベル、妊娠外および妊娠中の母親の子宮内膜および末梢血中のナチュラルキラー細胞(NK細胞 CD56、CD16)の高レベル、子宮内膜および血清中の多数のサイトカイン(特にγインターフェロン、腫瘍壊死因子α、インターロイキン-1および2)の高レベル濃度が含まれます。
現在、早期流産につながる同種免疫因子と、これらの状態を改善する方法が研究されています。治療法についてはコンセンサスが得られていません。一部の研究者によると、ドナーリンパ球による能動免疫は有意な効果をもたらさないとされていますが、一方で、このような免疫と免疫グロブリンによる治療が有意な効果をもたらすと報告する研究者もいます。
現在、妊娠初期における免疫調節薬の一つはプロゲステロンです。特に、妊娠初期の習慣性流産の女性において、子宮内膜のCD56細胞レベルが上昇した症例において、1日20mgのジドロゲステロン投与が有効なことが研究で証明されています。
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
遺伝的に決定された血栓症
遺伝的に決定される血栓形成傾向の以下の形態は、習慣性流産につながる妊娠中の血栓形成傾向状態であると考えられています。
- アンチトロンビンIII欠乏症。
- 第V因子変異(ライデン変異)。
- プロテインC欠乏症。
- プロテインS欠乏症。
- プロトロンビン遺伝子変異G20210A。
- 高ホモシステイン血症。
以下の場合には、血栓症のまれな原因を特定するための検査が必要です。
- 家族歴 - 親族に40歳未満で血栓塞栓症の既往歴がある。
- 40 歳未満での静脈血栓症および/または動脈血栓症の確実な発症歴。
- 患者および近親者における再発性血栓症。
- ホルモン避妊薬を使用している妊娠中および出産後の血栓塞栓症の合併症。
- 繰り返しの妊娠喪失、死産、子宮内発育遅延、胎盤早期剥離;
- 早発性妊娠高血圧症候群、HELLP症候群。
習慣性流産の感染性原因
習慣性流産の原因としての感染因子の役割については、現在広く議論されています。妊娠初期の初感染は、胎児に生存に適さない損傷を与え、散発的な自然流産につながることが知られています。しかし、感染が再活性化し、同時に流産を繰り返す可能性は極めて低いです。また、現在のところ、習慣性流産を引き起こす微生物は発見されていません。近年の研究では、習慣性流産と慢性子宮内膜炎を患う女性のほとんどにおいて、子宮内膜内に2~3種類以上の偏性嫌気性微生物およびウイルスが蔓延していることが示されています。
VM Sidelnikovaらによると、習慣性流産の女性では、妊娠外慢性子宮内膜炎の診断が症例の73.1%で組織学的に確認され、86.7%で子宮内膜内の日和見微生物の持続が観察されました。これは確かに免疫病理学的プロセスの活性化の原因である可能性があります。混合持続ウイルス感染症(単純ヘルペスウイルス、コクサッキーA、コクサッキーB、エンテロウイルス68〜71、サイトメガロウイルス)は、通常の産歴を持つ女性よりも習慣性流産の患者で有意に多く見られます。K. Kohutら(1997)は、一次反復流産患者の子宮内膜および脱落膜組織の炎症性変化の割合は、少なくとも1回の満期出産の履歴を持つ流産後の女性よりも有意に高いことを示しました。
子宮内膜における細菌およびウイルスのコロニー形成は、通常、免疫系および体の非特異的防御力(補体系、貪食作用)が感染因子を完全に排除できないことに起因し、同時にTリンパ球(ヘルパーT細胞、ナチュラルキラー)およびマクロファージの活性化によってその拡散が制限されます。上記のすべての症例において、微生物の持続性が起こり、慢性炎症部位への単核貪食細胞、ナチュラルキラー、ヘルパーT細胞による様々なサイトカインの合成が特徴付けられます。明らかに、このような子宮内膜の状態は、着床前期における局所免疫抑制の形成を妨げます。これは、保護バリアを形成し、異物胎児の拒絶を防ぐために必要です。
この点に関して、習慣性流産の女性は妊娠前に慢性子宮内膜炎の診断を受ける必要があります。この診断を確定または除外するために、月経周期の7~8日目に子宮内膜生検を実施し、子宮腔から採取した検体の組織学的検査、PCR検査、細菌学的検査を行います。診断確定後、慢性子宮内膜炎は骨盤内臓器の炎症性疾患の治療基準に従って治療されます。


