線維芽細胞症
記事の医療専門家
最後に見直したもの: 05.07.2025
医学において「線維弾性症」とは、弾性繊維の成長阻害によって引き起こされる、内臓や血管の表面を覆う結合組織の変化を指します。同時に、臓器壁やその構造の肥厚が認められ、これは必然的に、特に心血管系や呼吸器系といった生命維持に重要なシステムの機能に影響を及ぼします。これは、特に運動中の患者の健康状態の悪化を招き、生活の質と寿命に影響を与えます。
疫学
一般的に、結合組織の変化を伴い、内臓の膜や隔壁の肥厚を引き起こす疾患は、心臓線維弾性症と肺線維弾性症の2つのグループに分けられます。心臓病変は先天性と後天性の両方があり、肺線維弾性症は後天性疾患です。
肺線維弾性症は中年期(55~57歳前後)に発症し始めますが、症例の半数は小児期に病因を探る必要があります。症状が全く現れない「軽症期」が特徴的です。また、この疾患は男女差がなく、男女ともに発症する可能性があります。この比較的まれな病態は、主に肺上葉における胸膜および肺実質(機能細胞)の組織変化を特徴とします。病因と病態形成機序が未解明であるため、特発性病態に分類されています。医学用語では「胸膜実質線維弾性症」と呼ばれます。[ 1 ]
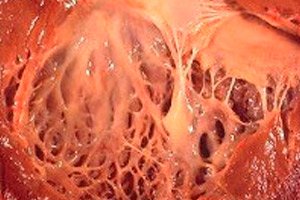
心臓線維弾性症は、心臓膜の肥厚と機能低下を特徴とする病態の総称です。先天性の病態は、心臓内膜のびまん性(広範囲にわたる)肥厚を特徴とします。内膜は、心臓の腔(その一部)を内張りし、弁を形成する薄い結合組織です。
成人患者の場合、心臓の内面がより強く厚い組織の斑点で覆われているように見える場合(過成長した繊維だけでなく、血栓の塊も含まれる可能性がある)、病気の局所形態が診断されるのが一般的です。
心臓線維弾性症の半数では、臓器壁が厚くなるだけでなく、弁(心房と心室の間の二尖僧帽弁、左心室と大動脈の間の三尖大動脈弁、右心室と肺動脈の間の肺動脈弁)も厚くなります。これにより弁の機能が損なわれ、心臓の他の腔に比べて既に狭い動脈口がさらに狭くなる可能性があります。
医学用語では、心内膜線維弾性症は心内膜線維弾性症(出生前線維弾性症、心内膜硬化症、胎児心内膜炎など)と呼ばれます。しかし、心臓膜の中間筋層もこの過程に関与していることがしばしばあります。[ 2 ]
心筋(心臓の筋肉層で、心筋細胞から構成されています)の構造異常、遺伝子変異、重度の感染症などが、一般的な線維弾性症の原因となることがあります。線維弾性症では、心内膜だけでなく心筋も病変に関与します。通常、様々な原因によって心内膜に生じる異形成は、筋膜との接触面において発生し、この層の収縮力を阻害します。場合によっては、心筋内層が心筋内に増殖し、心筋細胞が線維芽細胞や線維に置き換わることもあります。これは神経インパルスの伝導や心臓の律動に影響を及ぼします。
心筋が厚くなると心膜の厚み部分の血管が圧迫され、心筋への栄養供給が阻害されます(心筋虚血)。その結果、心筋組織の壊死につながる可能性があります。
心臓の心筋に損傷を伴う心内膜線維弾性症は、心内膜下線維弾性症または心内膜心筋線維弾性症と呼ばれます。
統計によると、このまれな病気のほとんどの症例(新生児総数のわずか0.007%)では、心臓の左心室の線維弾性症と診断されますが、場合によっては、このプロセスが右心室と心房、およびそれらを隔てる弁にも広がります。
心臓線維弾性症は、結合組織で覆われた大冠動脈の損傷を伴うことが多く、成人では進行性血管アテローム性動脈硬化症を背景に発症することが多い。
この病気は、栄養不良、頻繁な感染、特定の食品や植物の食用摂取などにより生活水準が低い熱帯アフリカ諸国の住民の間で多くみられます。
心内膜肥厚は、主に中年男性に発症するレフラー線維性心内膜炎の最終段階でも観察されます。この疾患の病因は、重度の好酸球増多症を引き起こす感染性病原体とも関連しており、これは内部寄生虫感染症でより典型的です。この場合、体の組織(主に心筋と脳)は酸素不足(低酸素症)に陥り始めます。心臓線維弾性症とレフラー線維性心内膜炎の症状は類似しているにもかかわらず、医師はこれらを全く異なる疾患とみなしています。
原因 線維芽細胞症
線維弾性症とは、心臓や肺といった重要臓器の結合組織に生じる変化を指し、臓器機能の障害を伴い、患者の容貌や病状に反映されます。医師はこの疾患を数十年前から認識していました。心臓の内膜(心内膜)の線維弾性症は18世紀初頭に既に報告されており、肺における同様の変化はそれから2世紀半後に議論され始めました。しかしながら、結合組織の病的な増殖の原因については、医師の間でいまだ最終的な合意に至っていません。
結合繊維の成長と発達の阻害の正確な原因は未だ解明されていません。しかし、科学者たちは、こうした変化の特定のリスク要因を特定し、それらを疾患の(最終的な原因ではないものの)可能性のある原因と見なしています。
このように、高齢者の疾患と考えられている肺線維弾性症の病態形成において、患者の半数に認められる臓器の再発性感染病変は特別な役割を果たしています。感染は肺組織と胸膜の炎症を引き起こし、長期にわたる炎症はそれらの線維化を促進します。
一部の患者には線維弾性症の家族歴があり、遺伝的素因が示唆されています。患者の体内には非特異的な自己抗体が検出され、原因不明の長期的な炎症プロセスを引き起こします。
肺組織の線維性変化は胃食道逆流症によって引き起こされる可能性があるという意見があります。この関連性は間接的である可能性が高いですが、心血管疾患や肺血栓症を患っている人は線維弾性症のリスクが高いと考えられています。
若年期および思春期の肺線維弾性症は、妊娠中に症状を思い出すことがあります。通常、この病気は10年以上潜伏しますが、妊婦の身体への負担の増加やホルモンの変化などにより、より早期に症状が現れる場合もありますが、正確な原因はまだ解明されていません。しかしながら、検査を受けた生殖年齢の患者の30%において、同様の病状の進行が認められました。
妊娠自体が病気を引き起こすことはありませんが、病気の進行を早める可能性があります。これは非常に残念なことです。なぜなら、この病気の死亡率は非常に高く、線維弾性症を患う人の平均余命は短いからです。
心臓線維弾性症は、ほとんどの場合、小児期の疾患に起因すると考えられます。先天性病変は、出生前4~7ヶ月の胎児において検出されますが、診断は出生後にのみ確定されます。この疾患の発症機序としては、母体の感染症および炎症性疾患が胎児に伝播すること、心膜の発達異常、心臓組織への血流障害、遺伝子変異、酸素不足など、いくつかの悪性因子が考えられます。
感染症の中で、心臓線維弾性症の発症に最も大きな病因となるのはウイルスであると考えられています。ウイルスは体内の細胞に埋め込まれ、それらを破壊し、組織の特性を変化させるからです。胎児の免疫系は未発達であるため、妊婦の免疫系とは異なり、これらの病原体から胎児を守ることができません。妊婦はウイルス感染の影響をほとんど受けない可能性がありますが、胎児においては子宮内感染が様々な異常を引き起こす可能性があります。
一部の科学者は、感染性線維弾性症の病因において決定的な役割を果たすのは、生後7ヶ月までの胎児に影響を及ぼす感染であると考えています。その後は、心臓の炎症性疾患(心筋炎、心内膜炎)を引き起こす可能性があります。
心臓の膜と弁の発達における異常は、炎症プロセスと不適切な自己免疫反応の両方によって引き起こされる可能性があり、その結果、免疫系の細胞が体自身の細胞を攻撃し始めます。
遺伝子にはタンパク質構造(特にコラーゲンとエラスチンタンパク質)の構造と動作に関する情報が含まれているため、遺伝子の変異は結合組織の異常な発達を引き起こします。
心臓組織の低酸素症と虚血は、心臓の発達異常の結果として生じることがあります。この場合、先天性心疾患(CHD)によって引き起こされる二次性線維弾性症と呼ばれます。これには、閉塞(心臓とその血管の開存性障害)を引き起こすような異常が含まれます。
- 弁付近の大動脈の狭窄または狭窄、
- 大動脈の弓部と下行部の接合部における大動脈縮窄または部分的な狭窄、
- 大動脈の閉鎖または自然開口部の欠如、
- 心臓組織(最も多いのは左心室、まれに右心室と心房)の発達不全で、心臓のポンプ機能に影響を及ぼします。
妊娠中の中毒症も胎児の線維弾性症の素因として作用する可能性があるという意見があります。
出生後期には、臓器膜の感染症や炎症性疾患、外傷による血行動態障害、血管血栓塞栓症、心筋出血、代謝障害(フィブリン形成の増加、タンパク質および鉄代謝障害:アミロイドーシス、ヘモクロマトーシス)によって心臓線維弾性症の発症が促進されることがあります。成人における発症も同様の原因となります。
病因
結合組織は人体の特殊な組織であり、ほぼすべての臓器の一部を構成しながらも、臓器の機能に積極的に関与することはありません。結合組織は支持機能と保護機能を担っています。一種の骨格(骨組み、間質)を形成し、臓器の機能細胞を制限して、最終的な形状と大きさを確保します。十分な強度を持つ結合組織は、臓器細胞を破壊や損傷から保護し、病原体の侵入を防ぎ、特殊なマクロファージ細胞の助けを借りて、死んだ組織細胞、異物タンパク質、老廃血液成分などの老廃物を吸収します。
この組織は、特定の臓器の機能を保証する細胞要素を含まないため、補助的な組織と言えるでしょう。しかしながら、体にとってのその役割は非常に大きく、血管の膜の一部である結合組織は、これらの構造の安全性と機能性を確保し、それによって体内環境の周囲組織への栄養と呼吸(栄養作用)を担っています。
結合組織にはいくつかの種類があります。内臓を覆う膜は疎性結合組織と呼ばれます。これは半液体状の無色の物質で、波状のコラーゲン繊維と直線状のエラスチン繊維を含み、その間に様々な種類の細胞がランダムに散在しています。これらの細胞の中には、線維芽細胞など線維構造の形成を担うものもあれば、内皮細胞や肥満細胞など半透明の結合組織マトリックスを形成し、ヘパリンやヒスタミンなどの特殊物質を産生するものもあります。また、マクロファージなど貪食作用を担うものもあります。
2つ目の種類の線維組織は緻密な結合組織で、多数の個別細胞を含んでおらず、白色組織と黄色組織に分けられます。白色組織は密集したコラーゲン繊維(靭帯、腱、骨膜)で構成され、黄色組織は線維芽細胞(靭帯の一部、血管膜、肺)を含む無秩序に絡み合ったエラスチン繊維で構成されています。
結合組織には、血液、脂肪、骨、軟骨組織も含まれますが、線維弾性症とは線維構造の変化を指すため、ここではこれらについては触れません。そして、弾性繊維と弾力繊維は、疎結合組織と密結合組織にのみ含まれています。
線維芽細胞の合成とそこからの結合組織繊維の形成は、脳レベルで制御されています。これにより、その特性(強度、弾力性、厚さ)が一定に保たれます。何らかの病理学的理由により、補助組織の合成と発達が阻害されると(線維芽細胞の数が増加し、「行動」が変化する)、強いコラーゲン繊維が増殖したり、弾力性のあるコラーゲン繊維の成長が変化したり(短くなり、ねじれたままになります)、臓器膜や結合組織で覆われた一部の内部構造の特性が変化します。結合組織は必要以上に厚くなり、密度が高く、強く、弾力性がなく、靭帯や腱の繊維組織に似た状態になり、伸ばすのに大きな労力が必要になります。
このような組織は十分に伸びないため、臓器の動き(心臓と血管の自動的なリズミカルな動き、吸入と呼気の際の肺の大きさの変化)が制限され、血液供給と呼吸器官が妨げられ、酸素欠乏につながります。
実のところ、体への血液供給は、ポンプとして機能する心臓と2つの血液循環によって行われています。肺循環は肺への血液供給とガス交換を担い、そこから酸素が血流とともに心臓へ送られ、そこから全身循環へと送られて全身に分配され、臓器や組織に呼吸を促します。
弾性膜は心筋の収縮を制限し、心臓の機能低下を引き起こします。心臓は血液を活発に送り出すことができなくなり、酸素も供給されなくなります。肺線維弾性症では肺の換気(酸素発生)が阻害され、血液中の酸素量が減少し始めます。たとえ心機能が正常であっても、組織や臓器の酸素欠乏(低酸素症)につながることは明らかです。[ 3 ]
症状 線維芽細胞症
心臓線維弾性症と肺線維弾性症は、結合組織における線維合成障害を特徴とする2種類の疾患です。病変の局在は異なりますが、どちらも進行性または重篤な心不全および呼吸不全を伴うため、生命を脅かす可能性があります。
肺線維弾性症は、呼吸器系の重要な器官である肺に生じる稀な間質性疾患です。肺実質の慢性病変を呈し、肺胞壁の損傷(炎症、構造の破壊)、肺毛細血管の内層膜の損傷などが見られます。線維弾性症は、肺と胸膜の組織に線維性変化が生じる傾向のある、進行性肺炎の稀な特殊な形態とみなされることが多いです。
病気の初期段階で発見することはほぼ不可能です。なぜなら、約10年間は症状が現れない可能性があるからです。この期間は「クリアインターバル」と呼ばれます。肺の容積やガス交換にまだ影響を及ぼさない病理学的変化の発現は、他の呼吸器系の疾患や外傷に関連して肺を精密検査した際に偶然発見されることがあります。
この病気は症状がゆっくりと進行する特徴があり、最初の兆候が現れるまでに発症からかなり時間がかかることがあります。症状は徐々に強くなります。
この病気の最初の兆候として注意すべきなのは、咳と息切れの増加です。これらの症状は、過去の呼吸器疾患の結果として現れることが多く、風邪とその影響と長期間にわたって関連している可能性があります。息切れは、心臓疾患や加齢に伴う変化と認識されることが多く、この病気は高齢期に差し掛かっている人に診断されることが多いのです。
患者と医師の双方がミスを犯す可能性があり、危険な疾患の発見が遅れる原因となります。線維弾性症では咳嗽は非排泄性ですが、粘液溶解薬や去痰薬では刺激されず、鎮咳薬で止まります。このような咳嗽は、肺線維弾性症の特徴的な症状です。
呼吸困難は、肺胞壁と胸膜の肥厚、肺胞腔の容積と数の減少(肺実質はX線写真で蜂の巣状に観察されます)による進行性の呼吸不全によって引き起こされます。この症状は運動負荷の影響下で増強し、最初は顕著ですが、その後は軽度にまで悪化します。病状が進行するにつれて症状は悪化し、患者は障害を負い、死に至ります。
線維弾性症の進行は、全身状態の悪化を伴います。低酸素症により衰弱やめまいが起こり、体重が減少し(食欲不振が発症)、爪の指骨がドラムスティック状に変化し、皮膚が青白くなり病弱な外観になります。
患者の半数は、呼吸困難や胸痛といった、気胸(胸腔内へのガスの蓄積)の特徴的な非特異的症状を呈します。この異常は、外傷、一次性および二次性の肺疾患、不適切な治療によっても発生する可能性があるため、診断は困難です。
心臓線維弾性症は、肺における結合組織の増殖の病理と同様に、皮膚の蒼白、体重減少、しばしば発作性の脱力、息切れを特徴とします。風邪や感染症の兆候がないにもかかわらず、微熱が持続する場合もあります。
多くの患者は肝臓の大きさの変化を経験します。肝臓は機能不全の症状を伴わずに大きくなります。脚、顔、腕、仙骨部の腫れも起こる可能性があります。
この疾患の特徴的な症状は、心臓の機能不全に伴う循環不全の悪化と考えられています。この場合、頻脈(心拍数の増加、しばしば不整脈を伴う)、息切れ(身体活動がない場合も含む)、組織チアノーゼ(血流の阻害、ひいてはガス交換の阻害により、血液中の一酸化炭素ヘモグロビン(ヘモグロビンと二酸化炭素の化合物)の蓄積によって引き起こされる青みがかった色調)が診断されます。
この場合、症状は、この病態を持つ子供の出生直後に現れる場合もあれば、一定期間を経て現れる場合もあります。年長児や成人が罹患する場合、重度の心不全の兆候は、通常、呼吸器感染症を背景に現れ、これが誘因となります。[ 4 ]
小児線維弾性症
肺線維弾性症は成人の疾患であり、多くの場合小児期に発症しますが、長期間にわたり症状が明らかになることはありません。一方、心臓心内膜の同様の病変は、乳児では出生前からしばしば現れ、出生直後からその生涯に影響を与えます。このまれではあるものの重篤な病変は、乳児において治療困難な心不全の発症原因となり、その多くは2年以内に死亡します。[ 5 ]
新生児における心内膜線維弾性症は、ほとんどの場合、胎児期に胎児の体内で起こる病理学的過程の結果です。母親からの感染症、遺伝子変異、心血管系の発達異常、遺伝性代謝疾患など、これらすべてが心膜の結合組織の変化につながると研究者は指摘しています。特に、生後4~7ヶ月の胎児が2つ以上の要因に同時に曝露された場合、その傾向は顕著になります。
例えば、心臓と冠動脈の発達における異常(狭窄、閉鎖、大動脈縮窄、心筋細胞の異常な発達、心内膜の虚弱化など)が組織虚血の一因となり、さらに感染による炎症過程が加わると、患児の生存率はほぼゼロになります。臓器発達の欠陥は早期に修正できますが、進行性線維弾性症は進行を遅らせることはできても、治癒することはできません。
通常、胎児の心臓線維弾性症は、妊娠中期または後期の超音波診断で既に検出されます。20~38週の超音波検査および心エコー検査では、心内膜の肥厚と圧縮(通常はびまん性、まれに局所性)を示す高エコー輝度が認められ、心臓の大きさと形状の変化(心臓が拡大し、球状または弾丸状になり、内部構造が徐々に滑らかになる)が見られます。[ 6 ]
線維弾性症は、妊娠26週までに30~35%の症例で発見され、その後65~70%の症例で発見されました。新生児の80%以上において、線維弾性症は閉塞性心疾患を併発しており、早期発見にもかかわらず二次性です。罹患児の半数に左室肥大が認められ、この特定の心臓構造における線維弾性症の有病率の高さを説明しています。心内膜増殖症を有する小児の3分の1に認められる大動脈およびその弁の病変も、左室腔の拡大(拡張)と機能障害を引き起こします。
心臓線維弾性症が機器検査で確認された場合、医師は妊娠中絶を勧めます。母親が薬物による中絶を拒否した際に生まれたほぼすべての子どもに、この病気の兆候が確認されました。線維弾性症の特徴である心不全の症状は、生後1年以内(まれに2~3歳)に現れます。この病気の複合型である子どもでは、生後数日から心不全の兆候が認められます。
小児における先天性原発性線維弾性症および混合性線維弾性症は、重度の心不全を伴い、急速に進行することが多い。活動性の低下、無気力、急速な疲労による授乳拒否、食欲不振、発汗増加は、健康状態の悪化を示唆する。これらすべてが、体重増加不良につながる。乳児の皮膚は痛々しいほど青白く、場合によっては青みがかった色を呈し、特に鼻唇三角部に顕著に現れる。
免疫力の低下の兆候が見られるため、このような子どもは呼吸器感染症にかかりやすく、事態を悪化させます。生後数日から数ヶ月は循環器系の障害が見られない場合もありますが、頻繁な感染症や肺疾患がうっ血性心不全の発症の引き金となります。
線維弾性症の疑いがある、または既に線維弾性症と診断された新生児および幼児の追加健康診断では、低血圧(低血圧症)、心臓肥大(心肥大)、心音聴診時の低音、時に僧帽弁閉鎖不全症に特徴的な収縮期雑音、頻脈、呼吸困難が認められました。肺の聴診では、うっ血を示唆する喘鳴が認められます。
左心室の心内膜損傷は、しばしば心臓の筋層(心筋)の脆弱化につながります。正常な心拍リズムは、2つの音(リズミカルに交互に現れる音)で構成されています。線維弾性症では、3つ目(場合によっては4つ目)の音(音)が現れることがあります。このような病的なリズムは明瞭に聴取でき、馬の3拍子の歩様(ギャロップ)に似ていることから、ギャロップリズムと呼ばれています。
幼児における線維弾性症のもう一つの症状は、心臓瘤の出現です。出生後初期の小児の肋骨は骨化せず、軟骨組織で形成されています。心臓が大きくなると、心臓が「柔らかい」肋骨を圧迫し始め、その結果、肋骨は曲がって前方に湾曲した形状(心臓瘤)を形成します。成人の線維弾性症では、心臓のあらゆる構造が肥大した場合でも、肋骨の骨組織の強度と硬さにより心臓瘤は形成されません。
心臓のこぶの形成自体は、先天性心疾患の存在を示すだけで、その性質を特定することはできません。しかし、いずれにせよ、心臓と心室の肥大と関連しています。
小児線維弾性症における浮腫症候群が診断されることは稀ですが、多くの小児が肝臓の肥大を経験し、肋骨弓の縁の下から平均 3 cm 突出し始めます。
線維弾性症が後天性の場合(例えば、心膜の炎症性疾患の結果として発症した場合)、臨床像はほとんどの場合、緩徐に進行します。しばらくは症状が全く現れないこともありますが、その後、運動中の息切れ、心拍数の増加、急激な疲労感、持久力の低下といった心機能障害の弱い兆候が現れます。その後しばらくすると、肝臓が腫大し始め、浮腫やめまいが現れます。
後天性線維弾性症の症状はいずれも非特異的であり、心筋症、肝疾患、腎疾患に類似しているため、診断を困難にします。この疾患は重度の心不全の段階で診断されることが最も多く、治療効果に悪影響を及ぼします。
合併症とその結果
心臓と肺の線維弾性症は深刻な病態であり、その経過は様々な状況によって異なります。先天性心疾患は病状を著しく複雑化させますが、これは早期に手術で除去できますが、同時に死亡リスクはかなり高くなります(約10%)。
病気の発症が早期であればあるほど、その影響は重篤になると考えられています。これは、先天性線維弾性症のほとんどの症例が、心不全の急速な進行を伴う劇症または急性の経過を辿るという事実によって裏付けられています。生後6ヶ月未満の乳児における急性心不全の発症は、予後不良の兆候と考えられています。
しかし、この治療は心機能の完全な回復を保証するものではなく、心不全の症状の進行を遅らせるだけです。一方で、このような支持療法が行われない場合、生後2年以内に死亡に至る可能性があります。
生後数日から数ヶ月の間に心不全が発見された場合、その子は1週間も生きられない可能性が高いです。治療への反応は子どもによって異なります。治療効果が見られない場合、希望は事実上ありません。しかし、適切な治療を行えば、病気の子の平均余命は短くなります(数ヶ月から数年)。
線維弾性症の原因となった先天性心疾患の手術と矯正は、通常、患者の状態を改善します。左室肥大の外科的治療が成功し、医師の指示に従うことで、病状は良性経過を辿る可能性があります。心不全は、進行の兆候なく慢性の経過を辿ります。ただし、このような結果が得られる可能性は低いです。
心臓線維弾性症の後天性は、急速に慢性化し、徐々に進行します。薬物療法で進行を遅らせることはできますが、完全に止めることはできません。
肺線維弾性症は、明期後の臓器実質および膜の変化の出現時期にかかわらず、急速に進行し、重度の呼吸不全を引き起こし、数年後には死に至ることもあります。残念なことに、この疾患の効果的な治療法は未だ開発されていません。[ 7 ]
診断 線維芽細胞症
心内膜心筋線維弾性症は、ほとんどの場合、幼少期に症状が現れる先天性疾患です。外傷や身体疾患の合併症として、小児期後期や成人期に発症する稀な症例を除けば、出生前、つまり出産前に病理を特定することが可能です。
医師たちは、心内膜組織の病理学的変化、胎児心臓の形状変化、そして線維弾性症の特徴である機能のいくつかの特徴は、妊娠14週目という早い時期に確認できると考えています。しかし、これはまだかなり短い期間であり、この病気がもう少し遅れて、妊娠後期、あるいは出産の2ヶ月前に発症する可能性も否定できません。そのため、妊婦のモニタリングでは、数週間間隔で胎児心臓の臨床的超音波検査を行うことが推奨されます。
次回の超音波検査で、医師はどのような兆候からこの病気を疑うことができるでしょうか?それは病気の形態によって異なります。線維弾性症は左心室の領域で診断されることが多いですが、この構造が必ずしも拡大しているわけではありません。心臓の左心室が拡大した拡張型の病気は、超音波検査中に、心臓の球形(その頂点は左心室で表されます)、臓器の全体的なサイズの拡大、および心室中隔が右心室に向かって膨らんでいることで簡単に判断できます。しかし、線維弾性症の主な兆候は、心内膜の肥厚と、これらの構造のエコー輝度の特徴的な増加を伴う心中隔であり、これは特定の超音波検査によって判断されます。
この検査は、心臓学プログラムを備えた特殊な超音波装置を用いて行われます。胎児心エコー検査は、母体や胎児に害を及ぼすことなく、心臓の解剖学的変化を特定するだけでなく、冠動脈の状態、冠動脈内の血栓の存在、心膜の厚さの変化などを調べることができます。
胎児心エコー検査は、超音波検査結果の解読中に異常がみられる場合だけでなく、母親の感染症(特にウイルス性)、強力な薬剤の服用、遺伝的素因、代謝障害の存在、および年長児の先天性心臓病変がある場合にも処方されます。
胎児心エコー検査では、他の先天性線維弾性症も検出できます。例えば、右心室線維弾性症(左心室と隣接構造(右心室、心臓弁、心房)の同時損傷を伴う広範な病態)、線維弾性症の複合型、心室内膜の肥厚と心筋の一部の病態への関与(通常は壁血栓症を伴う)を伴う心内膜線維弾性症などがあります。
出生前に心内膜線維弾性症が発見された場合、予後は非常に不良であるため、医師は妊娠中絶を推奨します。病変が明らかになった最初の検査から4週間後に胎児心臓の超音波検査を再度実施することで、誤診の可能性を排除します。妊娠中絶するか継続するかの最終決定は両親に委ねられていますが、両親は、自分が子供にどのような人生を送らせることになるのかを自覚する必要があります。
心内膜線維弾性症は、妊娠中に必ずしも発見されるわけではありません。特に、すべての妊婦が婦人科を受診し、予防的な超音波検査を受けているわけではないことを考慮すると、なおさらです。胎児の病気は妊婦の状態にほとんど影響を与えないため、病気の赤ちゃんの出産は、しばしば不快な驚きとなります。
場合によっては、両親と医師の両方が、生後数ヶ月経ってから赤ちゃんの病気に気づくことがあります。このような場合、血液検査ではナトリウム濃度の上昇(高ナトリウム血症)以外に何も見つからないこともあります。しかし、その結果は炎症性疾患を除外するための鑑別診断に役立ちます。
機器診断への期待はまだある。標準的な心臓検査(心電図)は、線維弾性症の症例においては特に有用なものではない。心臓の異常や心筋の電気伝導性を特定するのに役立つものの、そのような疾患の原因を特定できない。したがって、心電図電圧の変化(若年者では通常過小評価され、高齢者では逆に過度に高くなる)は心筋症を示唆しており、これは心臓病だけでなく代謝障害にも関連している可能性がある。頻脈は心臓疾患の症状である。また、両心室が影響を受けている場合、心電図は概して正常に見えることがある。[ 8 ]
コンピュータ断層撮影(CT)は、心血管石灰化の検出や心膜炎の除外に優れた非侵襲的な検査法である。[ 9 ]
生検は侵襲的であるため、磁気共鳴画像法(MRI)は線維弾性症の検出に有用となる可能性がある。心筋灌流シーケンスにおける低信号縁部および遅延造影シーケンスにおける高信号縁部は線維弾性症を示唆する。[ 10 ]
しかし、この研究は心臓の働きの性質や心不全の進行度合いを判断するのに役立つため、研究を放棄すべきだということではありません。
心不全の症状が現れ、患者が医師の診察を受けた場合、胸部X線検査、心臓CTまたはMRI検査、心エコー検査(心エコーCG)も処方されます。疑わしい場合は、心臓組織の生検とその後の組織学的検査が必要となります。診断は非常に重篤であるため、治療は冠動脈疾患や心不全の対症療法とほとんど変わりませんが、診断には同様のアプローチが必要です。
しかし、たとえ綿密な検査であっても、その結果が鑑別診断に用いられなければ意味がありません。心電図検査の結果は、急性線維弾性症と特発性心筋炎、滲出性心膜炎、大動脈弁狭窄症との鑑別に有用です。同時に、臨床検査では炎症の兆候(白血球増多、赤沈亢進など)は示されず、体温測定でも高体温は示されません。
心音と心雑音の分析、心房の大きさの変化、および既往歴の調査は、心内膜線維弾性症と単独の僧帽弁閉鎖不全症および僧帽弁欠損症を区別するのに役立ちます。
既往歴の分析は、線維弾性症と心臓および大動脈弁狭窄症との鑑別に有用です。大動脈弁狭窄症の場合、洞調律の維持と血栓塞栓症の欠如にも注意が必要です。滲出性心膜炎でも心調律障害や血栓沈着は認められませんが、発熱と体温上昇を伴って発症します。
最も困難なのは、心内膜線維弾性症とうっ血性心筋症の鑑別です。この場合、線維弾性症はほとんどの場合顕著な心臓伝導障害を伴わないものの、治療予後は不良です。
複合病変の場合、先天性欠損が線維弾性症の経過を著しく複雑化させるため、心臓の断層撮影や超音波検査で明らかになる異常には注意が必要です。子宮内に複合心内膜線維弾性症が認められた場合、妊娠を継続することは適切ではありません。中絶する方がはるかに人道的です。
肺線維弾性症の診断
肺線維弾性症の診断には、医師の一定の知識とスキルも必要です。実際、この疾患の症状は非常に多様です。一方ではうっ血性肺疾患(痰の絡まない咳、息切れ)を示唆し、他方では心臓病の兆候である可能性もあります。したがって、この疾患の診断は、症状の記述と聴診のみに限定することはできません。
患者の血液検査は炎症性肺疾患の除外に役立ちますが、組織の量的・質的変化に関する情報は得られません。好酸球増多の兆候は、症状が類似する肺線維症との鑑別に役立ちますが、線維弾性症を否定または確定するものではありません。
機器による検査は、より診断に役立つと考えられています。これには、胸部X線検査や呼吸器の断層撮影検査、呼吸量、肺活量、器官内の圧力を測定する機能分析などがあります。
肺線維弾性症の場合、スパイロメトリーで測定される外呼吸機能の低下に注意を払う必要があります。活動肺胞腔の減少は肺活量(VCL)に大きく影響し、内部構造の壁肥厚は肺拡散能(DCL)に影響を及ぼします。DCLは換気とガス交換機能(簡単に言えば、血液から二酸化炭素を吸収し、酸素を放出する機能)を担っています。
胸膜実質線維弾性症の特徴的な兆候は、肺への空気の流れの制限(閉塞)と吸入時の肺拡張障害(拘束)、外部呼吸機能の低下、中等度の肺高血圧(肺内の圧力の上昇)の組み合わせであり、患者の半数に診断されます。
肺組織生検では、臓器の内部構造に特徴的な変化が認められます。具体的には、胸膜および実質の線維化と肺胞壁の弾性線維化、肺胞中隔の緻密化部位におけるリンパ球の集積、線維芽細胞の典型的ではない筋組織への変化、そして浮腫性液の存在などが挙げられます。
断層像では、肺の上部に胸膜圧迫巣と実質の構造変化という形で損傷が認められます。肺の結合組織は肥大し、色調と性質において筋組織に類似していますが、肺の容積は減少しています。実質には非常に大きな空気を含んだ空洞(嚢胞)が認められます。気管支および細気管支の不可逆的な局所的(またはびまん的)拡張(牽引性気管支拡張症)と横隔膜ドームの位置低下が特徴的です。
放射線学的検査では、多くの患者に「すりガラス状肺」や「蜂巣肺」が認められ、組織が圧迫された病巣の存在により肺の換気が不均一になっていることを示しています。患者の約半数にリンパ節と肝臓の腫大が認められます。
肺線維弾性症は、寄生虫感染および関連する好酸球増多症によって引き起こされる線維症、心内膜線維弾性症、換気障害および「蜂の巣状肺」像を伴う肺疾患、自己免疫疾患であるX型組織炎(肺損傷を伴うこの病状の1つの形態はハンド・シューラー・クリスチャン病と呼ばれます)、サルコイドーシスおよび肺結核の症状と区別する必要があります。
処理 線維芽細胞症
線維性弾性症は、その発生部位に関わらず、危険で事実上治癒不可能な疾患と考えられています。胸膜および肺実質の病理学的変化は、薬物療法では回復できません。ホルモン性抗炎症薬(コルチコステロイド)と気管支拡張薬を併用しても、望ましい効果は得られません。気管支拡張薬は患者の症状をいくらか緩和し、閉塞症候群を軽減しますが、肺で起こっているプロセスには影響を与えないため、支持療法としてのみ使用できます。
肺線維弾性症に対する外科的治療も効果がありません。状況を改善できる唯一の手術はドナー臓器移植です。しかし、残念ながら肺移植も同様に予後不良です。[ 11 ]
海外の科学者によると、線維弾性症は肺または骨髄幹細胞移植の頻繁な合併症の一つとも考えられます。どちらの場合も、肺の結合組織線維に変化が生じ、外呼吸機能に影響を及ぼします。
治療せずに放置すると病気は進行し(現在有効な治療法は存在しません)、患者の約40%が1年半から2年以内に呼吸不全で死亡します。生存者の平均余命も著しく制限され(最大10~20年)、労働能力も低下します。患者は身体障害を負います。
心臓線維弾性症も、特に先天性の場合は、医学的に不治の病とみなされています。通常、患児は2歳まで生きられません。救命手段は心臓移植のみですが、それ自体が困難な手術であり、特にそのような年齢では、高いリスクと予測不可能な結果を伴うことがあります。
一部の赤ちゃんでは、先天性心疾患を外科的に治療することで、病状の悪化を防ぐことができます。動脈狭窄の場合は、血管拡張器(シャント)を設置します。心臓の左心室が拡張している場合は、その形状はすぐに元に戻ります。しかし、このような手術を受けたとしても、移植なしで生活できるという保証はありません。生存率は約20~25%ですが、彼らは生涯にわたって心不全に苦しみ、健康とは言えません。
病気にかかってしまった場合、薬の助けを借りて子供の命を守るために闘う価値はあります。しかし、病気の発症が早ければ早いほど、闘うことが難しくなることを理解することが重要です。
薬物療法は、心不全の悪化を予防し、その抑制を目的としています。患者には以下の心臓薬が処方されます。
- アンジオテンシン変換酵素(ACE)阻害剤は血圧に作用し、正常範囲内に維持します(カプトプリル、エナラプリル、ベナゼプリルなど)。
- 心拍リズム障害、動脈性高血圧症の治療、心筋梗塞の予防に使用されるベータ遮断薬(アナプリリン、ビソプロロール、メトプロロール)
- 強心配糖体は、長期間使用すると心臓の機能をサポートする(心筋細胞内のカリウム含有量を増加させ、心筋伝導性を改善する)だけでなく、心内膜肥厚の程度をある程度軽減することもできる(ジゴキシン、ギトキシン、ストロファンチン)。
- カリウム保持性利尿薬(スピロノラクトン、ベロシュピロン、デクリズ)、組織浮腫の予防、
- 抗凝固剤(カルディオマグニル、マグニコール)による抗血栓療法は、冠状血管における血栓の形成と循環障害を予防します。
先天性心内膜線維弾性症では支持療法は回復を促進しませんが、心不全や血栓塞栓症による死亡リスクを70~75%減少させます。[ 12 ]
薬
ご覧のとおり、心内膜線維弾性症の治療は心不全の治療と実質的に変わりません。どちらの場合も、心臓専門医は心疾患の重症度を考慮します。薬剤の処方は、患者の年齢、併存疾患、心不全の形態と程度を考慮し、厳密に個別に行われます。
後天性心内膜線維弾性症の治療には、5つのグループの薬剤が使用されます。各グループから1つの薬剤について考えてみましょう。
「エナラプリル」はACE阻害薬群に属する薬剤で、様々な用量の錠剤として製造されています。この薬剤は、冠動脈の血流を増加させ、動脈を拡張させ、脳循環に影響を与えることなく血圧を下げ、心臓の左心室の拡張を抑制します。また、心筋への血流を改善し、虚血の影響を軽減し、血液凝固をわずかに抑制して血栓の形成を防ぎ、軽度の利尿作用を有します。
心不全の場合、この薬は6ヶ月以上の期間、または永続的に処方されます。薬は最小用量(2.5mg)から開始し、3~4日ごとに2.5~5mgずつ徐々に増量します。永続的な用量は、患者が十分に忍容でき、血圧を正常範囲内に維持できる用量となります。
1日の最大服用量は40mgです。1回または2回に分けて服用できます。
血圧が正常範囲を下回る場合は、徐々に投与量を減らしてください。エナラプリルによる治療は急に中止しないでください。維持量として1日5mgを服用することが推奨されます。
この薬は成人患者の治療を目的としていますが、小児にも処方可能です(安全性は公式には確立されていませんが、線維弾性症の場合、小さな患者の生命に関わるため、リスク比を考慮します)。ACE阻害薬は、薬剤成分に対する不耐性、ポルフィリン症、妊娠中および授乳中の患者には処方されません。患者が過去にこのグループの薬剤を服用中にクインケ浮腫を発症したことがある場合、エナラプリルの使用は禁止されます。
重度の腎臓病や肝臓病、高カリウム血症、高アルドステロン症、大動脈弁狭窄症や僧帽弁狭窄症、全身性結合組織病変、心虚血、脳疾患、糖尿病などの併発病変を持つ患者にこの薬を処方する場合には注意が必要です。
本剤を投与する際は、脱水症状や強い降圧作用を避けるため、従来の利尿薬を服用しないでください。カリウム保持性利尿薬との併用は高カリウム血症のリスクが高く、不整脈、発作、筋緊張低下、脱力感の増強などを引き起こす可能性があるため、用量調整が必要です。
「エナラプリル」という薬は通常、忍容性が高いですが、一部の患者では副作用が現れる場合があります。最も一般的な副作用は、血圧の急激な低下(虚脱に至る)、頭痛やめまい、睡眠障害、疲労感の増加、平衡感覚、聴覚、視覚の可逆的な喪失、耳鳴り、息切れ、痰を伴わない咳、血液と尿の組成の変化(通常は肝臓と腎臓の機能不全を示唆)です。また、脱毛、性欲減退、「ほてり」(熱感、動悸、顔面皮膚の充血など)などの症状が現れる可能性もあります。
「ビソプロロール」は選択的作用を有するβ遮断薬で、降圧作用および抗虚血作用を有し、頻脈および不整脈の症状を軽減するのに役立ちます。錠剤型の安価な薬剤で、心内膜線維弾性症における心不全の進行を予防します。[ 13 ]
冠動脈疾患やうっ血性心不全に処方される他の多くの薬剤と同様に、ビソプロロールは長期間の服用が必要です。朝食前または食間に服用することをお勧めします。
推奨用量は、血圧値と併用薬に応じて個別に決定されます。平均的には、1回(または1日)の投与量は5~10mgですが、血圧がわずかに上昇した場合は2.5mgまで減量できます。腎機能が正常な患者には、持続的に高血圧の場合に限り、最大20mgまで処方できます。
指示された用量を増やすことは、医師の許可を得た場合にのみ可能です。ただし、重度の肝疾患や腎疾患の場合は、10mgが最大許容用量とみなされます。
左室機能不全を伴う心不全(線維弾性症を伴う場合が最も多い)の複合治療では、1.25mgずつ徐々に増量することで有効な用量を選択します。この場合、最小用量(1.25mg)から開始し、1週間ごとに増量します。
用量が5mgに達すると、投与間隔は28日に延長されます。4週間後、用量は2.5mgずつ増量されます。この間隔と基準を遵守すると、10mgに達しますが、患者は長期間または継続的に服用する必要があります。
このような用量に耐えられない場合は、徐々に快適なレベルまで減量してください。β遮断薬による治療を急に中止しないでください。
この薬は、薬の有効成分および補助成分に対する過敏症、急性および非代償性心不全、心原性ショック、2~3度の房室ブロック、徐脈、持続的な低血圧およびその他の心臓病、重度の気管支喘息、気管支閉塞、重度の末梢循環障害、代謝性アシドーシスの場合には処方しないでください。
複合治療を処方する際には注意が必要です。そのため、ビソプロロールと一部の抗不整脈薬(キニジン、リドカイン、フェニトインなど)、カルシウム拮抗薬、中枢性降圧薬との併用は推奨されません。
ビソプロロールによる治療中に起こりうる不快な症状や障害:疲労感の増加、頭痛、ほてり、睡眠障害、血圧低下、起床時のめまい、難聴、胃腸症状、肝機能障害および腎機能障害、勃起力の低下、筋力低下、けいれんなど。患者によっては、体温低下や四肢、特に手足のしびれといった末梢循環障害を訴える場合があります。
気管支肺系、腎臓、肝臓、糖尿病などの併発疾患がある場合、病気の悪化を示す副作用のリスクが高くなります。
「ジゴキシン」は、ジギタリスを原料とする、手頃な価格で人気の強心配糖体です。処方箋(錠剤)に基づいて厳密に調剤され、医師の監督下で使用する必要があります。冠動脈疾患およびうっ血性心不全の増悪時には、病院で注射による治療が行われ、錠剤は毒性があり麻薬のような作用があるため、最小限の有効量で継続的に処方されます。
治療効果は、心筋収縮の強度と振幅を変化させること(心臓にエネルギーを与え、虚血状態において心臓を補助すること)にあります。また、血管拡張作用(うっ血を軽減)と利尿作用も有し、腫れを軽減し、息切れとして現れる呼吸不全の重症度を軽減するのに役立ちます。
ジゴキシンやその他の強心配糖体の危険性は、過剰摂取すると心筋の興奮性が高まり不整脈を引き起こす可能性があることです。
うっ血性心不全が悪化した場合、薬剤は注射剤で処方され、症状の重症度と患者の年齢を考慮して個々の投与量が選択されます。症状が安定したら、錠剤に切り替えます。
通常、本剤の標準的な単回投与量は0.25mgです。投与頻度は1日1回から5回まで、等間隔で投与できます。うっ血性心不全の急性期には、1日投与量は1.25mgまで可能ですが、症状が恒常的に安定した場合は、1日0.25mg(通常は0.5mg)の維持量を服用する必要があります。
小児に薬を処方する際には、患者の体重を考慮します。有効かつ安全な投与量は、体重1kgあたり0.05~0.08mgと算出されます。ただし、薬は継続的に処方されるのではなく、1~7日間に分けて処方されます。
強心配糖体の投与量は、患者の状態と年齢を考慮して医師が処方する必要があります。同時に、投与量を個別に調整したり、同じ効果を持つ薬剤を2種類同時に服用したりすることは非常に危険です。
「ジゴキシン」は、不安定狭心症、重度の不整脈、2~3度の房室ブロック、心タンポナーデ、アダムス・ストークス・モルガニ症候群、孤立性二尖弁狭窄症および大動脈弁狭窄症、先天性心奇形(ウォルフ・パーキンソン・ホワイト症候群)、閉塞性肥大型心筋症、心内膜炎、心周囲炎、心筋炎、胸部大動脈瘤、高カルシウム血症、低カリウム血症、その他の病態には処方されません。禁忌リストは非常に長く、複数の症状を伴う症候群も含まれているため、この薬剤の使用可能性の判断は専門医のみが行うことができます。
ジゴキシンには副作用もあります。具体的には、不整脈(誤った用量選択や過剰摂取による)、食欲不振、吐き気(しばしば嘔吐を伴う)、腸障害、重度の脱力感と強い疲労感、頭痛、眼球の前への「ハエ」の出現、血小板減少と血液凝固障害、アレルギー反応などが挙げられます。これらの症状やその他の症状は、ほとんどの場合、薬剤の大量投与に伴って現れますが、長期投与ではそれほど多くは見られません。
「スピロノラクトン」はミネラルコルチコイド拮抗薬です。利尿作用を有し、ナトリウム、塩素、水の排泄を促進しますが、心臓の伝導機能は主にカリウムに依存しているため、正常な機能に必要なカリウムは保持します。浮腫を軽減します。うっ血性心不全の補助薬として用いられます。
うっ血性心不全(CHF)の場合、薬剤は病期に応じて処方されます。増悪期には、1日50~100mgの用量で、注射剤または錠剤で処方されます。病状が安定したら、25~50mgの維持量を長期間処方します。カリウムとナトリウムのバランスが崩れ、カリウムが減少する場合は、微量元素の濃度が正常になるまで用量を増量します。
小児科では、有効投与量は患者の体重1キログラムあたり1~3 mgのスピロノラクトンの比率に基づいて計算されます。
ご覧のとおり、心臓病学で使用される他の多くの薬剤の処方の場合と同様に、ここでも推奨用量の選択は個別に行われます。
利尿薬の使用禁忌としては、体内のカリウム濃度の過剰またはナトリウム濃度の低さ、排尿障害(無尿)、重度の腎機能障害などが挙げられます。この薬は、妊婦、授乳中の女性、および薬の成分に不耐性のある方には処方されません。
房室ブロック(悪化する可能性があります)、カルシウム過剰(高カルシウム血症)、代謝性アシドーシス、糖尿病、月経不順、肝疾患のある患者が本剤を使用する場合は注意が必要です。
この薬を服用すると、頭痛、眠気、バランス感覚および運動協調の喪失(運動失調)、男性の乳腺肥大(女性化乳房)およびインポテンス、月経の性質の変化、女性の声の荒化および過剰な体毛の成長(多毛症)、心窩部痛および胃腸障害、腸疝痛、腎機能障害、ミネラルバランスの乱れが生じる可能性があります。皮膚反応およびアレルギー反応が起こる可能性もあります。
副作用は通常、必要な用量を超えた場合に観察されます。用量が不十分な場合は、浮腫が発生する可能性があります。
「マグニコール」は、アセチルサリチル酸と水酸化マグネシウムを主成分とする、血栓の形成を予防する薬剤です。心不全に処方される抗血栓療法の有効な手段の一つです。鎮痛作用、抗炎症作用、抗血小板作用を有し、呼吸機能にも影響を与えます。水酸化マグネシウムは、アセチルサリチル酸が消化管粘膜に及ぼす悪影響を軽減します。
心内膜心筋線維弾性症の場合、本剤は予防目的で処方されるため、最小有効用量は75mg(1錠相当)とします。血栓形成とそれに続く冠動脈内腔の狭窄に起因する心虚血の場合、初期用量は2錠とし、維持用量は予防用量に相当します。
推奨用量を超えると、止血が困難になるリスクが大幅に高まります。
この薬にはアセチルサリチル酸が含まれているため、15 歳未満で使用すると深刻な結果を招く恐れがあり、投与量は成人患者向けとなっています。
この薬は、小児および思春期初期の患者、アセチルサリチル酸および他の薬の成分に対する不耐性がある場合、「アスピリン」喘息(既往歴あり)、急性びらん性胃炎、消化性潰瘍、出血性素因、重度の肝臓および腎臓疾患、重度の代償不全心不全の場合には処方されません。
妊娠中のマグニコールは、胎児および妊娠経過への悪影響の可能性を考慮し、極めて必要な場合にのみ、妊娠第1~2トリメスターにのみ処方されます。妊娠第3トリメスターでは、子宮収縮力の低下(分娩延長)や重度の出血を引き起こす可能性があるため、この治療は望ましくありません。胎児に肺高血圧症や腎機能障害が生じる可能性があります。
この薬の副作用には、消化管症状(消化不良、心窩部痛および腹痛、鉄欠乏性貧血の発症に伴う胃出血のリスクなど)が含まれます。服用に伴い、鼻血、歯茎出血、泌尿器系臓器の出血が起こる可能性があります。
過剰摂取は、めまい、失神、耳鳴りを引き起こす可能性があります。アレルギー反応は珍しくなく、特にサリチル酸塩に対する過敏症の場合に多く見られます。ただし、アナフィラキシーや呼吸不全はまれな副作用です。
複合療法における薬剤の選択と推奨投与量は、厳密に個別に判断する必要があります。妊婦、授乳中の母親、小児、高齢者への治療には特に注意が必要です。
伝統医学とホメオパシー
心臓線維弾性症は、特徴的な進行性経過をたどり、回復の可能性がほとんどない重篤な疾患です。民間療法では、このような疾患を効果的に治療することは不可能であることは明らかです。主にハーブ療法に由来する伝統医学の処方は、既に不良な予後を悪化させないため、補助的な手段としてのみ、医師の許可を得てのみ使用することができます。
ホメオパシー療法については、その使用は禁止されておらず、心不全の包括的な治療の一部として活用することができます。ただし、ここでは治療というよりも、心不全の進行を予防することに焦点を当てています。
これらの薬は、経験豊富なホメオパシー医によって処方されるべきであり、複合療法にこれらを含める可能性については、主治医の権限の範囲内である。
線維弾性症における心不全の進行を遅らせるのに効果的なホメオパシー薬にはどのようなものがありますか?急性心不全の場合、ホメオパシー療法士は、アルセニカム・アルバム、アンチモン・タータリカム、カーボ・ベゲタビリス、アシダム・オキサリカムなどの薬剤を使用します。適応症は類似していますが、効果的な薬剤を選択する際には、医師はチアノーゼなどの虚血の外部症状(その程度と有病率)と疼痛症候群の性質を考慮します。
CHF の場合、維持療法には以下のものが含まれることがあります:ラケシスおよびナユ、リコプス(心臓肥大の初期段階)、ラウロセラスス(安静時の息切れに)、ラトロデクトゥス マクタンス(弁膜疾患に)、サンザシ製剤(心内膜心筋病変に特に有効)。
心拍が強い場合は、対症療法として、スピゲリア、グロノイナム(頻脈用)、オーラムメタリカム(高血圧用)が処方されることがあります。
息切れの重症度を軽減するには、グリンデリア、スポンジア、ラヘギスが効果的です。心臓の痛みを和らげるには、サボテン、セレウス、ナヤ、クプルムが処方されます。また、心臓性喘息の発症には、ジギタリス、ローロセラス、リコプスが適応となります。
防止
心臓と肺の後天性線維弾性症の予防は、感染症や炎症性疾患、特に重要臓器の損傷につながる疾患の予防と適切な治療から成ります。基礎疾患の効果的な治療は、線維弾性症を含む危険な結果の予防に役立ちます。これは、自分自身の健康だけでなく、将来の世代の健康にも気を配り、いわゆる「健康な未来と長寿のための努力」を行う絶好の機会です。
予測
心臓および肺線維弾性症に伴う結合組織の変化は不可逆的であると考えられています。一部の薬剤は長期治療により心内膜の厚さをある程度軽減できますが、治癒を保証するものではありません。この病態は必ずしも致命的ではありませんが、予後は依然として比較的不良です。4年生存率は77%です。[ 14 ]
すでに述べたように、最も予後が悪いのは先天性心線維弾性症です。この疾患では、生後数週間から数ヶ月で心不全の症状が既に現れます。心臓移植のみが赤ちゃんを救うことができますが、このような早期段階での心臓移植はリスクの高い手術であり、2歳までに実施する必要があります。このような赤ちゃんは通常、それ以上生きられません。
その他の手術では、早期死亡を回避できるだけですが(必ずしも回避できるとは限りません)、心不全を完全に治癒することはできません。代償不全と呼吸不全の進行により、死亡に至ることもあります。
肺線維弾性症の予後は、病気の特性によって異なります。症状が急速に進行した場合、生存の可能性は極めて低くなります。病気が徐々に進行した場合、肺胞の変化により呼吸不全に陥るまで、約10~20年は生存可能です。
治療困難な病態の多くは、予防措置を講じることで回避できます。心臓線維弾性症の場合、まず第一に、胎児の心臓と循環器系の発達に影響を与える可能性のある要因(遺伝的素因や突然変異は除く。これらについては医師の力で対処することはできません)を予防することが重要です。回避できない場合は、早期診断を行うことで、妊娠中絶が可能な段階で病態を特定することができ、この状況では人道的とみなされます。


