心筋アキネジア
記事の医療専門家
最後に見直したもの: 12.07.2025
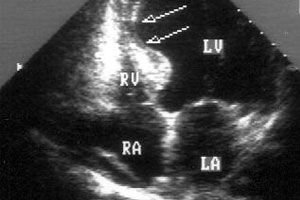
原因 心筋アキネジア
なぜ心筋の収縮が止まってしまうのか、つまり心筋無動症の原因は何でしょうか?
心臓病学の実地診療において、心筋の正常な収縮機能(健康な心臓では自動的に行われることは周知の事実ですが)の喪失の病態は、心筋梗塞と、その結果として機能している心筋細胞の一部が壊死することと最もよく関連しています。心筋梗塞後の心筋の修復変化(リモデリング)は、まず梗塞領域の拡大を招き、続いて心室の形状が歪み拡張し、心筋細胞壊死領域が瘢痕化し、心筋無動領域を形成します。線維性変化は心室を隔てる心室中隔にも影響を及ぼす可能性があり、超音波検査では心室中隔領域に無動が認められます。
心筋梗塞は、心臓虚血または虚血性心疾患(IHD) の急性症状であり、冠動脈系の血液循環が阻害され、心筋の低酸素症と心筋細胞の死につながることで発症します。
心筋梗塞後に心筋膜が薄くなり、その突出(動脈瘤)が生じた場合には、超音波心電図検査で左心室の無動が明らかになります。患者の約3分の2では、左心室の前壁または心尖部に動脈瘤が形成され、心尖部の無動も認められます。
さらに、心筋無動症を視覚化する心エコー検査の結果と、心筋梗塞後心筋症候群(損傷した心筋細胞が線維組織に置き換わる特徴的な心筋梗塞後の局所的またはびまん的な心筋硬化症、および心臓伝導系の損傷(洞房結節または房室結節の細胞による生体電気インパルスの伝導障害))との間には相関関係があります。
心筋変性または心筋ジストロフィーの場合、心筋硬化症に類似した組織学的所見を呈しますが、心筋組織の構造変化により局所的な心筋無動も示されます。
感染性心筋炎の患者では、洞房結節の細胞に損傷が生じ、筋壁の運動振幅が減少し、収縮が消失する、つまり運動低下と無動が併発することがよくあります。この疾患は、ウイルス(アデノウイルス、エンテロウイルス、ピコルナウイルス科、コクサッキーウイルス、パルボウイルスB、風疹ウイルス、HSV-6)、細菌(ジフテリア菌、インフルエンザ菌、ボレリア・ブルグドルフェリ、肺炎マイコプラズマ)、原生動物(クルーズトリパノソーマ、トキソプラズマ)、真菌(アスペルギルス)、または寄生虫(回虫、単包条虫、ウェステルマン肺吸虫など)によって引き起こされる炎症により、間質における炎症性浸潤の形成および局所的な心筋細胞融解を伴うことがあります。臨床統計によると、感染性心筋炎の症例のほとんどは、ジフテリア、インフルエンザ、エンテロウイルス、およびトキソプラズマによって引き起こされます。
また、自己免疫性心筋炎(全身性エリテマトーデス、強皮症、関節リウマチ、ホイップル病などに伴う)では、左心室の無動および機能不全が発生し、生命を脅かす不整脈を伴うことがあります。
これとは別に、心臓専門医はストレス性心筋症(たこつぼ型心筋症)を区別します。国内の専門医はこれをブロークンハート症候群と呼んでいます。これは、左心室中心尖部における突然の一過性の収縮不全で、冠動脈疾患の既往のない高齢女性において、ストレスの多い状況でよく発生します。特に、左心室基部には過活動領域が検出され、その上方には心尖部の無動が認められます。また、心臓超音波検査では、心室中隔領域における運動不足が診断医によって検出されることがあります。
危険因子
心筋無動症という形で心筋領域の正常な運動機能障害を引き起こす主な危険因子は、虚血性心疾患の発症です。そして、その発症の危険因子は、以下のものと考えられています。
- 男性の場合は45歳以上、女性の場合は55歳以上。
- 早期心臓病の家族歴;
- 血液中のコレステロールを運ぶHDL(高密度リポタンパク質)のレベルの低下と、血管壁へのコレステロールの沈着に寄与する低密度リポタンパク質(LDL)のレベルの上昇(動脈硬化)。
- 血中のトリグリセリド値が高い(食事に関連)
- 高血圧;
- 血圧の上昇や冠動脈へのコレステロール沈着に寄与する代謝障害(メタボリックシンドローム)。
- 喫煙(受動喫煙を含む)、肥満、運動不足、精神的ストレス、うつ病。
心筋に影響を与えるウイルスや細菌の感染、そして自己免疫疾患は、血中C反応性タンパク質(CRP)値の上昇といった心筋虚血の危険因子を引き起こします。また、組織プラスミノーゲン活性化因子(tPA)とその阻害因子(PAI)の不均衡によって心臓血管の正常な状態が損なわれ、冠静脈が完全に閉塞する血栓症の危険が高まります。
症状 心筋アキネジア
心筋無動症(心血管疾患の心エコー所見)の場合、臨床像はこれらの病態の症状によって決定されます。具体的には、息切れ、心臓周辺の様々な強度の痛み、不整脈(心房性または心室性)、心室粗動、失神などが挙げられます。
そのため、たこつぼ型心筋症の患者は、胸骨の後ろの痛み(締め付けられるような性質)が左肩甲骨に放散し、吸入時に空気が不足する感覚を訴えることが最も多いです。
心筋炎に伴う痛みは、急性の場合もあれば、持続する場合もあります(ニトログリセリンを使用しても効果はありません)。また、鈍い痛み(締め付けられるような痛み)もあります。さらに、この感染性疾患の心臓症状には、息切れ、発熱、心拍数の増加、心拍動、電光石火の血行動態障害(血流量速度の低下)、意識喪失、そして突然の心臓死などが含まれます。
合併症とその結果
確かに、心筋無動症は、梗塞後瘢痕領域のジスキネジアと比較して、心筋梗塞患者の生命にとってより深刻な危険をもたらします。研究によると、冠動脈閉塞を伴う梗塞症例の約40%において、虚血部位の血流が適時に回復(再灌流)すれば、梗塞後2~6週間以内に心筋収縮力が回復することが示されています。しかし、その帰結や合併症には、突然の心タンポナーデ、電気機械的解離、そして死亡が含まれます。
部分的な運動不全を伴う心筋のジストロフィー変化の結果と合併症は、筋線維のほぼ不可避な萎縮につながり、不整脈や収縮期駆出率の低下として現れるだけでなく、慢性循環不全を伴う心室の拡張としても現れることがあります。
左室無動症、それに伴う収縮不全、および心不全は、突然の心臓死のリスクを予測する最も強力な因子の一つです。
 [ 23 ]
[ 23 ]
何を調べる必要がありますか?
差動診断
非典型的な臨床像を呈する患者や診断上不確定な心電図結果を示す患者における胸痛の鑑別診断には、心エコー検査も使用されます。
心筋運動障害のない患者では、心エコー検査によって、重度の肺塞栓症や大動脈解離など、同様の臨床像を示す生命を脅かす他の疾患を検出することができます。
さらに、心筋の診断には、収縮機能障害の場合も含めて、ESR、C反応性タンパク質レベル、抗体(血清のIgMレベル分析)、電解質レベルなどの血液検査、および心筋損傷マーカー(トロポニンIおよびTアイソザイム、クレアチンキナーゼ)の測定が含まれます。
患者は心電図(ECG)、X線造影冠動脈造影、断層シンチグラフィー(放射性同位元素使用)、カラー組織ドップラー、MRIなどの検査を受けます。心動脈瘤の診断には、X線造影心室造影検査が必要です。
場合によっては、心筋の鑑別診断は、心内膜心筋生検と、それに続く採取したサンプルの組織学的検査によってのみ可能となります。
連絡先
処理 心筋アキネジア
心筋の治療は、損傷した部位への血液供給(灌流)と伝導機能を回復し、局所的な心筋細胞壊死の領域を制限し、細胞代謝を活性化することを目的としています。
臨床現場では、複数の薬理学的グループの薬剤が用いられます。急性冠症候群および心外膜冠動脈閉塞性血栓症では、血栓溶解薬(ストレプトキナーゼ、プロウロキナーゼ、アルテプラーゼ)と抗血小板薬(チクロピジン、硫酸クロピドグレル、またはプラビックス)を用いた再灌流療法が行われます。
慢性心不全では、血圧を調節するアンジオテンシン変換酵素(ACE)を阻害する薬剤が使用されます。カプトプリル、エナラプリル、ラミプリル、フォシノプリルなどがその例です。これらの薬剤の投与量は、心臓専門医が特定の疾患と心電図検査結果に基づいて決定します。例えば、カプトプリル(カプリル、アロプレシン、テンシオミン)は1回12.5~25mgを1日3回、食前に経口または舌下投与します。この薬剤およびこのグループのほとんどの薬剤の副作用には、頻脈、血圧低下、腎機能障害、肝不全、吐き気と嘔吐、下痢、蕁麻疹、不安の増大、不眠症、知覚異常、振戦、血液の生化学的組成の変化(白血球減少症を含む)などがあります。 ACE 阻害剤は、特発性心筋疾患、高血圧、大動脈および腎血管の狭窄、副腎皮質の過形成変化、腹水、妊娠および小児の場合には使用されないことに注意してください。
冠動脈疾患および心筋症の場合、末梢血管拡張薬群の抗虚血薬、例えばモルシドミン(モタゾミン、コルバトン、シドノファーム)やアドボカードが処方されることがあります。モルシドミンは経口投与され、1回1錠(2mg)を1日3回服用します。低血圧および心原性ショックの場合は禁忌であり、副作用として頭痛が認められます。
抗不整脈薬および降圧薬であるベラパミル(ベラカード、レコプチン)は、頻脈および狭心症を伴う冠動脈疾患の治療に用いられます。1回1錠(80mg)を1日3回服用してください。副作用として、吐き気、口渇、腸障害、頭痛、筋肉痛、不眠症、蕁麻疹、心拍異常などが現れることがあります。この薬は、重度の心不全、心房細動および徐脈、低血圧には禁忌です。
ミルドロネート(メルドニウム、アンジオカルジル、バソネート、カルディオネートなどの商品名)は、強心作用および抗低酸素作用を有します。1日2回、1カプセル(250mg)を服用することが推奨されます。この薬剤は成人患者のみに使用可能であり、脳循環障害および脳の構造的病変のある患者には禁忌です。ミルドロネートの使用により、頭痛、めまい、不整脈、息切れ、口渇、咳、吐き気、腸障害などの副作用が起こる可能性があります。
冠動脈疾患治療薬β1遮断薬群(メトプロロール、プロプラノロール、アテノロール、アセブトロールなど)は、主に血圧を下げ、心筋細胞膜上の受容体の交感神経刺激を低下させることで心拍数と心拍出量を減少させ、心筋細胞の酸素消費量を増加させ、疼痛を軽減します。例えば、メトプロロールは1日2回1錠ずつ、アテノロールは1日1錠ずつ服用します。しかし、この群の薬剤は急性心不全や心房・心室ブロックのリスクを高めるため、うっ血性心不全、非代償性心不全、徐脈、循環器疾患がある場合は禁忌です。そのため、現在多くの専門家がこれらの薬剤の抗不整脈効果に疑問を呈しています。
医師はビタミンB6、B9、Eの摂取と、心臓の伝導系をサポートするためにカリウムとマンガンを含む薬剤(パナンジン、アスパルカムなど)の服用を推奨しています。
外科的治療
冠動脈の損傷を伴う梗塞(心筋虚血領域の形成と心室の拡張を伴う心筋虚血無動症につながる)の場合、心臓への血流を回復させる外科的治療(大動脈冠動脈バイパス術)が適応となります。
虚血性心疾患の場合、冠動脈拡張(内腔の拡張)法、すなわちステント留置術が用いられます。
運動障害性動脈瘤に対しては、動脈瘤切除術(切除)、動脈瘤腔の縫合(動脈瘤形成術)、または動脈瘤壁の強化のいずれかによる外科的治療が最もよく使用されます。
動的心筋形成術(Dynamic Cardiomyoplasty)の方法が開発されました。この方法では、電気刺激を受けた骨格筋(通常は広背筋の縁から採取した弁)を心臓の一部(第二肋骨の部分切除を含む)に巻き付け、心筋収縮力を回復または増強します。この弁は心室周囲に縫合され、植込み型心臓ペースメーカーの筋肉内電極を用いて心臓収縮と同期した刺激が行われます。
防止
リスク要因のセクションに戻ると、心血管疾患を予防する方法が明らかになります。重要なのは、体重を増やさず、運動量を増やし、コレステロールが血管壁にプラークとして沈着しないようにすることです。そのためには、40歳を過ぎてから(そして血縁者に心臓病の既往歴がある場合)、動脈硬化のための食事療法に従うことが有効です。
そしてもちろん、心臓専門医は、心筋の虚血性障害を予防するためには禁煙が最も重要な条件であると考えています。実際、喫煙すると、赤血球のヘモグロビンタンパク質が吸入したタバコの煙のガスと結合し、心臓に非常に有害な化合物、すなわち一酸化炭素ヘモグロビンを形成します。この物質は血球による酸素運搬を阻害し、心筋細胞の低酸素症と心筋虚血の発症につながります。
こちらもお読みください –心筋梗塞後心硬化症の予防


