カテコールアミンの合成、分泌、代謝
記事の医療専門家
最後に見直したもの: 06.07.2025
副腎髄質は、ステロイドとはかけ離れた構造を持つ化合物を生成します。これらは3,4-ジヒドロキシフェニル(カテコール)核を含み、カテコールアミンと呼ばれます。これにはアドレナリン、ノルアドレナリン、ドーパミンβ-ヒドロキシチラミンが含まれます。
カテコールアミン合成の順序は非常に単純です。チロシン → ジヒドロキシフェニルアラニン(DOPA) → ドーパミン → ノルエピネフリン → アドレナリンです。チロシンは食物とともに体内に取り込まれますが、肝臓ではフェニルアラニン水酸化酵素の作用によりフェニルアラニンから生成されます。組織におけるチロシン変換の最終生成物はそれぞれ異なります。副腎髄質ではこのプロセスはアドレナリン生成の段階に進み、交感神経終末ではノルエピネフリンが、中枢神経系の一部のニューロンではカテコールアミン合成はドーパミン生成で終了します。
チロシンからDOPAへの変換は、テトラヒドロビオプテリンと酸素を補因子とするチロシン水酸化酵素によって触媒されます。この酵素はカテコールアミン生合成過程全体の速度を制限し、その最終生成物によって阻害されると考えられています。チロシン水酸化酵素は、カテコールアミン生合成に対する調節作用の主な標的です。
DOPAからドーパミンへの変換は、比較的非特異的で、他の芳香族L-アミノ酸を脱炭酸する酵素DOPA脱炭酸酵素(補因子:ピリドキサールリン酸)によって触媒されます。しかし、この酵素の活性を変化させることで、カテコールアミンの合成を変化させる可能性が示唆されています。一部のニューロンはドーパミンをさらに変換するための酵素を欠いており、それが最終生成物となります。他の組織には、ドーパミンをノルエピネフリンに変換するドーパミンβヒドロキシラーゼ(補因子:銅、アスコルビン酸、酸素)が含まれています。副腎髄質(交感神経終末部を除く)には、ノルエピネフリンからアドレナリンを形成するメチルトランスフェラーゼであるフェニルエタノールアミンが存在します。この場合、S-アデノシルメチオニンがメチル基供与体として機能します。
フェニルエタノールアミン-N-メチルトランスフェラーゼの合成は、門脈系を介して皮質から髄質に流入するグルココルチコイドによって誘導されることを覚えておくことが重要です。これは、2つの異なる内分泌腺が1つの臓器に統合されているという事実を説明できるかもしれません。アドレナリンの合成におけるグルココルチコイドの重要性は、ノルアドレナリンを産生する副腎髄質の細胞が動脈血管の周囲に位置するのに対し、アドレナリン産生細胞は主に副腎皮質にある静脈洞から血液を受け取っているという事実によって強調されています。
カテコールアミンの分解は、主にカテコール-O-メチルトランスフェラーゼ(COMT)とモノアミン酸化酵素(MAO)という2つの酵素系の作用下で起こります。アドレナリンとノルアドレナリンの分解の主な経路は、図54に模式的に示されています。メチル基供与体であるS-アドレノシルメチオニンの存在下でCOMTの作用下、カテコールアミンはノルメタネフリンとメタネフリン(ノルアドレナリンとアドレナリンの3-O-メチル誘導体)に変換されます。これらはMAOの作用下でアルデヒドに変換され、その後(アルデヒド酸化酵素の存在下で)、ノルアドレナリンとアドレナリンの主な分解産物であるバニリルマンデル酸(VMA)に変換されます。同様に、カテコールアミンが最初にCOMTではなくMAOに曝露されると、3,4-ジオキソマンデルアルデヒドに変換され、その後、アルデヒド酸化酵素とCOMTの影響下で3,4-ジオキソマンデル酸とVMCに変換されます。アルコール脱水素酵素の存在下では、カテコールアミンから中枢神経系におけるアドレナリンおよびノルアドレナリン分解の主な最終生成物である3-メトキシ-4-オキシフェニルグリコールが形成されます。
ドーパミンの分解も同様ですが、その代謝産物にはベータ炭素原子のヒドロキシル基が欠如しているため、バニリルマンデル酸の代わりにホモバニリン酸 (HVA) または 3-メトキシ-4-ヒドロキシフェニル酢酸が生成されます。
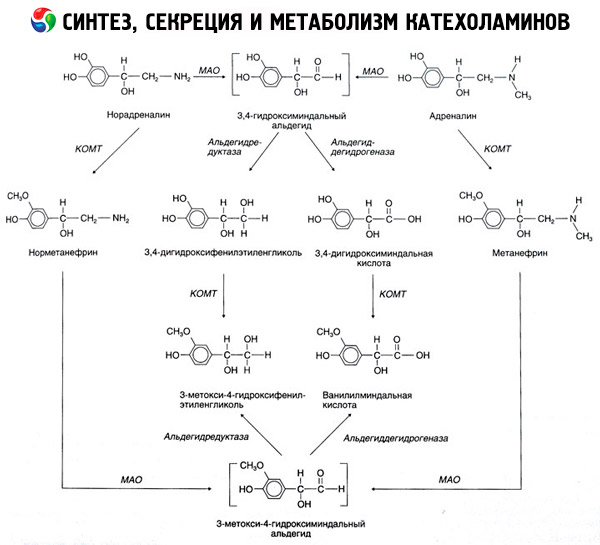
顕著な生物学的活性を持つ中間生成物を生成する可能性のある、カテコールアミン分子の酸化のキノイド経路の存在も仮定されている。
交感神経終末および副腎髄質の細胞質酵素の作用によって生成されたノルエピネフリンとアドレナリンは分泌顆粒に入り、分解酵素の作用から保護されます。カテコールアミンが顆粒に取り込まれるにはエネルギー消費が必要です。副腎髄質のクロマフィン顆粒では、カテコールアミンはATP(4:1の比率)と特定のタンパク質(クロモグラニン)と強く結合しており、顆粒から細胞質へのホルモンの拡散を防いでいます。
カテコールアミンの分泌を直接刺激するのは、カルシウムが細胞内に浸透し、エキソサイトーシス(顆粒膜と細胞表面の融合とそれが破裂し、可溶性の内容物(カテコールアミン、ドーパミンβヒドロキシラーゼ、ATP、クロモグラニン)が細胞外液に完全に放出される)を刺激することだと思われます。
カテコールアミンの生理学的効果とその作用機序
カテコールアミンの作用は、標的細胞の特定の受容体との相互作用から始まります。甲状腺ホルモンやステロイドホルモンの受容体は細胞内に局在していますが、カテコールアミン(およびアセチルコリンやペプチドホルモン)の受容体は細胞外表面に存在します。
いくつかの反応に関しては、アドレナリンまたはノルアドレナリンが合成カテコールアミンであるイソプロテレノールよりも効果的である一方、他の反応に関しては、イソプロテレノールの効果がアドレナリンまたはノルアドレナリンの作用よりも優れていることが長い間確立されてきました。これに基づいて、組織にはαとβの2種類のアドレナリン受容体が存在し、組織によってはこれら2種類のうちの1種類しか存在しないという概念が生まれました。イソプロテレノールはβアドレナリン受容体の最も強力な作動薬であり、合成化合物であるフェニレフリンはαアドレナリン受容体の最も強力な作動薬です。天然カテコールアミンであるアドレナリンとノルアドレナリンは、両方のタイプの受容体と相互作用することができますが、アドレナリンはβ受容体に対して、ノルアドレナリンはα受容体に対してより高い親和性を示します。
カテコールアミンは、平滑筋β受容体よりも心臓βアドレナリン受容体を強く活性化するため、β型はβ1受容体(心臓、脂肪細胞)とβ2受容体(気管支、血管など)のサブタイプに分類されます。イソプロテレノールのβ1受容体への作用は、アドレナリンやノルアドレナリンの作用のわずか10倍ですが、β2受容体への作用は天然カテコールアミンの100~1000倍強力です。
特異的拮抗薬(α受容体にはフェントラミンとフェノキシベンザミン、β受容体にはプロプラノロール)の使用により、副腎皮質受容体の分類の妥当性が確認されました。ドーパミンはα受容体とβ受容体の両方と相互作用しますが、様々な組織(脳、下垂体、血管)にも独自のドーパミン受容体があり、その特異的遮断薬はハロペリドールです。β受容体の数は細胞あたり1000~2000個です。β受容体を介したカテコールアミンの生物学的作用は、通常、アデニル酸シクラーゼの活性化と細胞内cAMP含量の増加を伴います。受容体と酵素は機能的に関連していますが、異なる高分子です。グアノシン三リン酸(GTP)およびその他のプリンヌクレオチドは、ホルモン受容体複合体の影響下でアデニル酸シクラーゼ活性の調節に関与する。酵素活性を増強することにより、これらの物質はβ受容体のアゴニストに対する親和性を低下させると考えられる。
神経支配を失った構造における感受性の増大という現象は古くから知られています。一方、アゴニストへの長期曝露は標的組織の感受性を低下させます。β受容体の研究により、これらの現象の説明が可能になりました。イソプロテレノールへの長期曝露は、β受容体数の減少によりアデニル酸シクラーゼの感受性を低下させることが示されています。
脱感作のプロセスはタンパク質合成の活性化を必要とせず、不可逆的なホルモン受容体複合体の漸進的な形成に起因すると考えられます。一方、交感神経終末を破壊する6-オキシドパミンの導入は、組織内の反応性β受容体数の増加を伴います。交感神経活動の増加は、カテコールアミンに関連して、血管や脂肪組織の加齢性脱感作を引き起こす可能性もあります。
様々な臓器におけるアドレナリン受容体の数は、他のホルモンによって制御される可能性があります。例えば、エストラジオールは子宮内のαアドレナリン受容体の数を増加させ、プロゲステロンは減少させます。これは、カテコールアミンに対する子宮収縮反応の増減を伴います。β受容体作動薬の作用によって形成される細胞内「セカンドメッセンジャー」がcAMPであることは事実ですが、αアドレナリン作用の伝達物質に関する状況はより複雑です。cAMPレベルの減少、cAMP含有量の増加、細胞内カルシウム動態の調節など、様々なメカニズムの存在が想定されます。
体内で様々な効果を再現するには、通常、ノルアドレナリンの5~10分の1の量のアドレナリンが必要です。後者はαおよびβ1アドレナリン受容体に対してより効果的ですが、内因性カテコールアミンはαおよびβ受容体の両方と相互作用できることを覚えておくことが重要です。したがって、アドレナリン活性化に対する特定の臓器の生物学的反応は、その臓器に存在する受容体の種類に大きく依存します。しかし、これは交感神経副腎系の神経性または体液性リンクの選択的活性化が不可能であることを意味するものではありません。ほとんどの場合、その様々なリンクの活動の増加が観察されます。したがって、低血糖は副腎髄質を反射的に活性化し、血圧の低下(起立性低血圧)は主に交感神経終末からのノルアドレナリンの放出を伴うことが一般的に認められています。
副腎皮質受容体と様々な組織におけるその活性化の影響
システム、器官 |
アドレナリン受容体型 |
反応 |
心臓血管系: |
||
心臓 |
ベータ |
心拍数、伝導性、収縮力の増加 |
細動脈: |
||
皮膚と粘膜 |
アルファ |
削減 |
骨格筋 |
ベータ |
拡大 縮小 |
腹部臓器 |
アルファ(詳細) |
削減 |
ベータ |
拡大 |
|
静脈 |
アルファ |
削減 |
呼吸器系: |
||
気管支の筋肉 |
ベータ |
拡大 |
消化器系: |
||
胃 |
ベータ |
運動能力の低下 |
腸 |
アルファ |
括約筋の収縮 |
脾臓 |
アルファ |
削減 |
ベータ |
リラクゼーション |
|
外分泌膵臓 |
アルファ |
分泌の減少 |
泌尿生殖器系: |
アルファ |
括約筋の収縮 |
膀胱 |
ベータ |
駆出筋の弛緩 |
男性器 |
アルファ |
射精 |
目 |
アルファ |
瞳孔の拡張 |
レザー |
アルファ |
発汗の増加 |
唾液腺 |
アルファ |
カリウムと水の排泄 |
ベータ |
アミラーゼ分泌 |
|
内分泌腺: |
||
膵島 |
||
ベータ細胞 |
アルファ(詳細) |
インスリン分泌の減少 |
ベータ |
インスリン分泌の増加 |
|
アルファ細胞 |
ベータ |
グルカゴン分泌の増加 |
8セル |
ベータ |
ソマトスタチン分泌の増加 |
視床下部と下垂体: |
||
ソマトトロフ |
アルファ |
STH分泌の増加 |
ベータ |
STH分泌の減少 |
|
乳腺刺激ホルモン産生菌 |
アルファ |
プロラクチン分泌の減少 |
甲状腺刺激ホルモン産生細胞 |
アルファ |
TSH分泌の減少 |
副腎皮質刺激ホルモン分泌細胞 |
アルファ |
ACTH分泌の増加 |
| ベータ | ACTH分泌の減少 | |
甲状腺: |
||
濾胞細胞 |
アルファ |
甲状腺ホルモン分泌の減少 |
ベータ |
チロキシンの分泌増加 |
|
傍濾胞細胞(K細胞) |
ベータ |
カルシトニン分泌の増加 |
副甲状腺 |
ベータ |
PTH分泌の増加 |
腎臓 |
ベータ |
レニン分泌の増加 |
胃 |
ベータ |
ガストリンの分泌増加 |
BX |
ベータ |
酸素消費量の増加 |
肝臓 |
? |
グルコースの放出によるグリコーゲン分解および糖新生の増加、ケトン体の放出によるケトン生成の増加 |
脂肪組織 |
ベータ |
遊離脂肪酸とグリセロールの放出による脂肪分解の増加 |
骨格筋 |
ベータ |
ピルビン酸と乳酸の放出を伴う解糖の増加;アラニン、グルタミンの放出の減少を伴うタンパク質分解の減少 |
カテコールアミンの静脈内投与の結果が、必ずしも内因性化合物の作用を適切に反映するとは限らないことを念頭に置くことが重要です。これは主にノルエピネフリンに当てはまります。体内では、ノルエピネフリンは主に血中ではなく、シナプス間隙に直接放出されるからです。したがって、内因性ノルエピネフリンは、例えば血管のα受容体(血圧の上昇)だけでなく、心臓のβ受容体(心拍数の増加)も活性化します。一方、体外からのノルエピネフリンの投与は、主に血管のα受容体の活性化と、迷走神経を介した反射的な心拍数低下をもたらします。
低用量のアドレナリンは、主に筋肉血管と心臓のベータ受容体を活性化し、末梢血管抵抗の減少と心拍出量の増加をもたらします。場合によっては、最初の効果が優勢になり、アドレナリン投与後に低血圧が発生することがあります。高用量では、アドレナリンはアルファ受容体も活性化し、末梢血管抵抗の増加を伴い、心拍出量の増加を背景に動脈圧の上昇につながります。ただし、血管ベータ受容体への効果も維持されます。その結果、収縮期血圧の上昇は、同様の指標である拡張期血圧(脈圧の上昇)を上回ります。さらに高用量のアドレナリンを投与すると、アドレナリンのアルファ模倣効果が優勢になり始め、ノルエピネフリンの影響下と同様に、収縮期血圧と拡張期血圧が同時に上昇します。
カテコールアミンの代謝への影響は、直接的な影響と間接的な影響から成ります。前者は主にβ受容体を介して発現します。より複雑なプロセスは肝臓に関連しています。肝臓でのグリコーゲン分解の増加は、従来β受容体の活性化の結果と考えられてきましたが、α受容体の関与を示す証拠もあります。カテコールアミンの間接的な影響は、インスリンなど、他の多くのホルモンの分泌の調節に関連しています。アドレナリンの分泌への影響においては、αアドレナリンの成分が明らかに優勢です。これは、あらゆるストレスがインスリン分泌の抑制を伴うことが示されているためです。
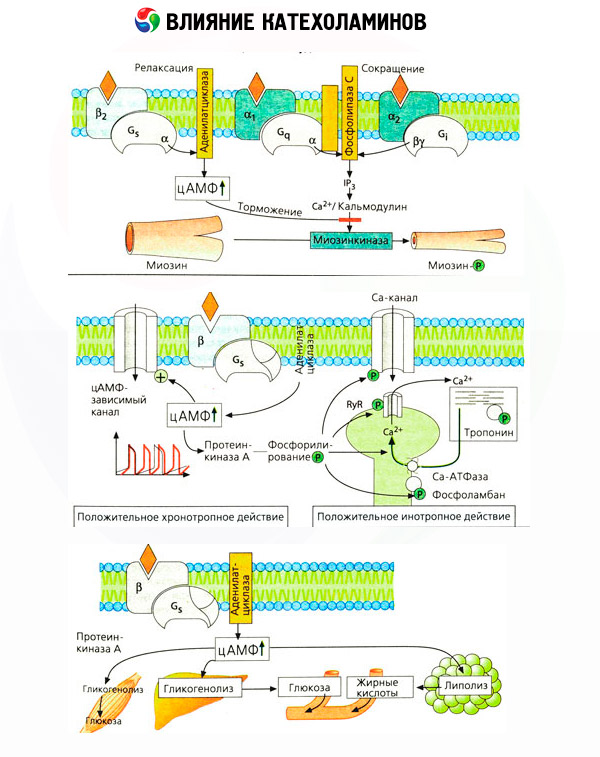
カテコールアミンの直接的および間接的な作用の組み合わせは、肝臓でのブドウ糖産生の増加だけでなく、末梢組織によるブドウ糖利用の阻害を伴う高血糖を引き起こします。脂肪分解の促進は、肝臓への脂肪酸の輸送増加とケトン体産生の増強を伴う高脂血症を引き起こします。筋肉における解糖の促進は、血中への乳酸およびピルビン酸の放出増加につながり、これらは脂肪組織から放出されるグリセロールと共に、肝臓での糖新生の前駆体として機能します。
カテコールアミン分泌の調節。交感神経系と副腎髄質の産物と反応様式の類似性は、これらの構造を単一の交感神経・副腎系に統合し、その神経系とホルモン系の連結を統合する基礎となりました。様々な求心性信号は視床下部、脊髄中枢、延髄に集中しており、そこから遠心性メッセージが発せられ、脊髄の側角に位置する節前ニューロンの細胞体へと伝達されます。この細胞体は頸椎第VIII節から腰椎第II-III節のレベルにあります。
これらの細胞の節前軸索は脊髄から出て、交感神経節に位置するニューロン、または副腎髄質の細胞とシナプス結合を形成します。これらの節前線維はコリン作動性です。交感神経節後ニューロンと副腎髄質のクロマフィン細胞の最初の根本的な違いは、後者は受信したコリン作動性信号を神経伝導(節後アドレナリン神経)ではなく、体液性経路によって伝達し、アドレナリン作動性化合物を血中に放出することです。2つ目の違いは、節後神経はノルアドレナリンを産生するのに対し、副腎髄質細胞は主にアドレナリンを産生することです。これら2つの物質は組織に対して異なる作用を及ぼします。


