ジフテリアの原因と病因
記事の医療専門家
最後に見直したもの: 04.07.2025
ジフテリアは毒素産生感染症の典型例です。1883年、クレブスはジフテリア菌(Corynebacterium diphtheriae)がジフテリアの原因菌であることを実証しました。1年後、レフラーはこの菌が鼻咽頭腔からのみ培養できることを発見し、内臓への損傷は可溶性毒素によるものだと提唱しました。1888年までに、ルーとイェルサンは、ジフテリア菌の滅菌濾液を注射された動物に、ヒトのジフテリアと区別がつかない臓器病変が現れることを証明しました。これは、強力な外毒素が主要な病原性因子であることを実証しました。
ジフテリアは、ほとんどの場合、発熱、咽頭痛、倦怠感を引き起こす上気道感染症です。感染部位には、細菌の増殖、毒素産生、基礎組織の壊死、そして宿主の免疫反応といった複合的な作用により、厚い灰緑色のフィブリン膜(偽膜)が形成されることがよくあります。全身臓器障害がジフテリア毒素の作用によるという認識から、急性感染症の治療に効果的な抗毒素療法と、非常に効果的なトキソイドワクチンが開発されました。
トキソイドワクチン接種により、公衆衛生基準でワクチン接種が義務付けられている地域ではジフテリアは稀な疾患となったものの、未接種者や免疫不全者の間では依然としてジフテリアの発生がみられます。一方、積極的予防接種プログラムが中断された地域では、ジフテリアが流行規模にまで拡大する大規模な流行が発生しています。
他の種類のコリネバクテリア
C. diphtheriae、C. ulcerans、C. pseudotuberculosisに加え、C. pseudodiphtheriticumとC. xerosisもまれに鼻咽頭感染症および皮膚感染症を引き起こすことがあります。後者2株はピラジナミダーゼ産生能によって識別されます。獣医学においては、C. renaleとC. kutscheriが重要な病原体であり、それぞれ牛の腎盂腎炎とマウスの潜伏感染を引き起こします。
原因
ジフテリアの原因菌であるジフテリア菌は、細くわずかに湾曲した桿菌で、両端に棍棒状の肥厚部があり、動かず、胞子、莢膜、鞭毛を形成せず、グラム陽性菌です。
ジフテリア・コリネバクテリアは毒素に加え、その生存過程でノイラミニダーゼ、ヒアルロニダーゼ、溶血素、壊死因子および拡散因子を生成し、結合組織の主成分の壊死および液化を引き起こす可能性があります。
ジフテリア・コリネバクテリアは、毒素を形成する能力に基づいて、毒素産生性と非毒素産生性に分類されます。
ジフテリア毒素は、強力な細菌外毒素であり、この疾患の全身症状および局所症状の両方を規定します。毒素産生性は遺伝的に決定されます。ジフテリアの非毒素産生性コリネバクテリアは、この疾患を引き起こしません。
培養学的および形態学的特徴に基づき、ジフテリア・コリネバクテリアは、gravis、mitis、intermediusの3つの変異体に分類されます。ジフテリア・コリネバクテリアの変異体の種類によって、疾患の重症度は直接的に左右されるわけではありません。それぞれの変異体には、毒素産生株と非毒素産生株の両方が含まれます。毒素産生コリネバクテリアは、いずれの変異体も同一の毒素を産生します。[ 1 ]
構造、分類、抗原の種類
ジフテリア菌(Corynebacterium diphtheriae)は、グラム陽性で運動性のない棍棒状の菌です。組織培養または長期間培養された菌株は、細胞壁に微細な斑点を有し、グラム染色時に脱色し、グラム染色の程度が変動します。長期間培養された菌株は、しばしばメタクロマティック顆粒(ポリメタリン酸)を含み、メチレンブルーで青紫色に染まります。細胞壁糖には、アラビノース、ガラクトース、マンノースが含まれます。さらに、トレハロースの毒性のある6,6'-エステルが単離されることもあり、これには等モル濃度のコリネミコール酸とコリネミコレン酸が含まれています。培養菌株は、ミティス(mitis)、インターメディウス(intermedius)、グラビス(gravis)の3種類に分類されます。
ほとんどの菌株は生育にニコチン酸とパントテン酸を必要としますが、チアミン、ビオチン、ピメリン酸を必要とする菌株もあります。ジフテリア毒素を最適に生産するには、培地にアミノ酸を補充し、保存する必要があります。
1887年という早い時期に、レフラーは、健康な人から分離された非毒性(毒素産生性)のジフテリア菌株について報告しました。この菌株は、患者から分離された毒性(毒素産生性)株と区別がつきません。現在では、非毒性のジフテリア菌株は、ジフテリア毒素の構造遺伝子toxを持つ複数の異なるコリネバクテリオファージのいずれかに感染し、溶原化することで毒性表現型へと転換することが知られています。非毒性表現型から毒性表現型への溶原化は、in situおよびin vitroの両方で起こり得ます。ジフテリア毒素の構造遺伝子は、コリネバクテリオファージにもジフテリア菌にも必須ではありません。この観察にもかかわらず、ジフテリア毒素の遺伝的浮動は観察されていません。
病因
感染の侵入口は、口腔咽頭、鼻腔、喉頭の粘膜、そして稀に眼や性器の粘膜、さらには損傷した皮膚、創傷や火傷の表面、おむつかぶれ、未治癒の臍帯創などです。侵入口では、ジフテリア菌が増殖し、外毒素を分泌します。
フィブリノーゲンを豊富に含む滲出液が滲出され、上皮細胞の壊死時に放出されるトロンボキナーゼの影響を受けてフィブリンに変換されます。フィブリン膜が形成され、これはジフテリアの特徴的な徴候です。
ジフテリア流行地域では、無症候性の鼻咽頭保菌が一般的です。感受性のある人では、毒素産生株が複製し、鼻咽頭または皮膚病変でジフテリア毒素を分泌することで疾患を引き起こします。ジフテリア病変は、しばしばフィブリン、細菌、炎症細胞からなる偽膜で覆われています。ジフテリア毒素はタンパク質分解によって、N末端断片A(触媒ドメイン)と断片B(膜貫通ドメインおよび受容体結合ドメイン)の2つの断片に切断されます。断片Aは、伸長因子2のNAD+依存性ADPリボシル化を触媒し、真核細胞におけるタンパク質合成を阻害します。断片Bは細胞表面受容体に結合し、断片Aの細胞質への輸送を促進します。
防御免疫には、臨床疾患後のジフテリア毒素に対する抗体反応、または免疫付与後のジフテリア毒素(ホルムアルデヒドによって不活性化された毒素)に対する抗体反応が含まれます。
植民地化
ジフテリア菌の定着を媒介する因子についてはほとんど分かっていない。しかし、ジフテリア毒素産生以外の因子が毒性に寄与していることは明らかである。疫学的研究により、特定のリゾタイプが長期間にわたって集団内に残存できることが示されている。後に別のリゾタイプに置き換わることもある。集団内での新しいリゾタイプの出現とその後の優位性は、鼻咽頭生態学的地位の当該セグメント内で定着し、効率的に競争する能力とおそらく関連している。ジフテリア菌はノイラミニダーゼを産生することができ、これは細胞表面のシアリン酸をその成分であるピルビン酸とN-アセチルノイラミン酸に分解する。コード因子(6,6'-ジ-O-ミコロイル-α, α'-D-トレハロース)はジフテリア菌の表面成分であるが、ヒト宿主への定着におけるその役割は不明である。
ジフテリア毒素の産生
ジフテリア毒素の構造遺伝子toxは、近縁のコリネバクテリオファージファミリーに属し、その中で最も研究が進んでいるのはβファージです。ジフテリア毒素の発現制御は、ジフテリア菌ゲノムにコードされている鉄活性化リプレッサーDtxRによって行われます。毒素の発現はジフテリア菌の生理状態に依存します。鉄が増殖速度を制限する基質となる条件下では、鉄はDtxRから解離し、トキシコデンドロン遺伝子が活性化され、ジフテリア毒素が最大速度で合成され、培養液中に分泌されます。
ジフテリア毒素は非常に強力で、感受性のある動物種(ヒト、サル、ウサギ、モルモットなど)では、体重1kgあたり100~150 ngの濃度でも致死量となります。ジフテリア毒素は、535個のアミノ酸からなる単一のポリペプチド鎖で構成されています。生化学的、遺伝学的、およびX線構造解析により、この毒素は3つの構造/機能ドメインから構成されていることが示されています。
- N末端ADPリボシルトランスフェラーゼ(触媒ドメイン)
- 細胞膜を介した触媒ドメインの送達を促進する領域(膜貫通ドメイン)
- 真核細胞受容体結合ドメイン。
ジフテリア毒素は、軽度のトリプシン消化および変性条件下での還元により、プロテアーゼ感受性ループで特異的に切断され、2つのポリペプチド断片(AおよびB)に分解される。断片Aは毒素のN末端21kDa成分であり、伸長因子2(EF-2)のADPリボシル化の触媒部位を含む。
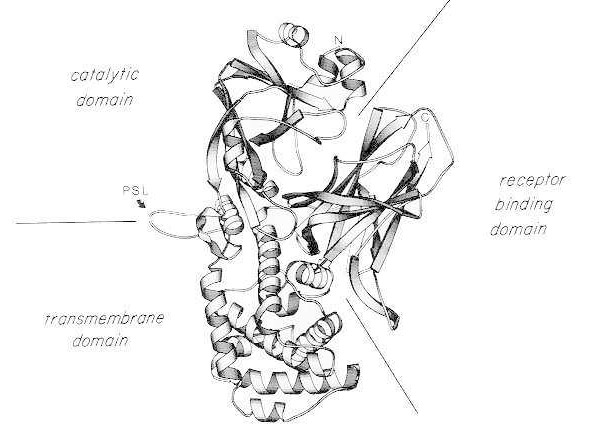
単量体天然ジフテリア毒素のX線結晶構造のリボン図。(Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling aliances between protein. Proc Natl Acad Sci, USA, 91: 3127, 1994より改変)。触媒ドメイン、膜貫通ドメイン、受容体結合ドメインの相対的な位置が示されている。未変性の毒素は、プロテアーゼ感受性ループ(PSL)に位置するArg190、Arg192、および/またはArg193において、トリプシン様プロテアーゼによって切断される。Cys186とCys201間のジスルフィド結合を還元すると、毒素はAフラグメントとBフラグメントに分解される。未変性の毒素のアミノ末端(N)とカルボキシ末端(C)が示されている。ストリップ チャートは、MOLESCRIPT プログラムを使用して作成されました。
C 末端フラグメントであるフラグメント B は、毒素の膜貫通ドメインと受容体結合ドメインを運びます。
ジフテリア毒素による単一の真核細胞の中毒には、少なくとも 4 つの異なる段階が含まれます。
- 毒素が細胞表面の受容体に結合すること。
- 荷電受容体が被覆小孔に集まり、受容体を介したエンドサイトーシスによって毒素が内部に取り込まれる。膜結合型ATP駆動型プロトンポンプによってエンドサイトーシス小胞が酸性化された後、
- 膜貫通ドメインの膜への挿入と触媒ドメインの細胞質への送達の促進、および
- EF-2 の ADP リボシル化により、タンパク質合成が不可逆的に抑制されます。
細胞質に送達された触媒ドメインの単一分子は、細胞に致命的となるのに十分であることが示されています。
感受性真核細胞のジフテリア中毒の模式図。
毒素は細胞表面受容体に結合し、受容体を介したエンドサイトーシスによって内部化されます。エンドソームが酸性化されると、膜貫通ドメインが小胞膜に挿入されます。触媒ドメインは細胞質に送達され、タンパク質合成の阻害と細胞死を引き起こします。
疫学
米国でジフテリアトキソイドによる集団予防接種が行われる以前は、ジフテリアは通常、小児疾患でした。ジフテリアトキソイドによる集団予防接種の注目すべき点は、抗毒素免疫の防御レベル(≥ 0.01 IU/mL)を持つ人口の割合が増加するにつれて、人口から毒素産生株が分離される頻度が減少することです。今日、臨床ジフテリアがほぼ完全に消滅した米国では、C. diphtheriae の毒素産生株が分離されることはまれです。不顕性感染はもはやジフテリア抗原への曝露源とならず、また追加免疫を行わない限り抗毒素に対する免疫が減弱するため、成人の大部分(30~60%)は抗毒素レベルが防御レベルを下回り、リスクに晒されています。米国、ヨーロッパ、東ヨーロッパでは、最近のジフテリアの発生は主にアルコールや薬物を乱用する人々の間で発生しています。このグループの中で、毒素産生性ジフテリア菌の保菌者は、中程度の高い抗毒素免疫を有しています。近年、ロシアでは公衆衛生対策の崩壊により、ジフテリアが流行病に陥っています。1994年末までに、ロシアでは8万人以上の症例と2,000人以上の死亡が報告されています。
ジフテリアの局所的発生は、ほとんどの場合、ジフテリアが風土病となっている地域から帰国した免疫キャリアに関連しています。実際、米国とヨーロッパにおける最近の臨床的ジフテリアの発生は、ロシアと東ヨーロッパから帰国した旅行者に関連していました。毒素産生菌株は、空気中の飛沫によって人から人へ直接感染します。毒素産生菌株は鼻咽頭腔に直接定着することが知られています。さらに、毒素産生コリネバクテリオファージの放出や、非毒素産生の土着ジフテリア菌の溶原性転換によって、毒素産生遺伝子が間接的に拡散することもあります。[ 5 ]
ジフテリア菌分離株のバイオタイプおよびリゾタイプの決定に加え、分子生物学的手法を用いてジフテリアのアウトブレイクを研究することが可能になりました。ジフテリア菌染色体DNAの制限酵素消化パターンは、臨床アウトブレイクの研究に利用されており、クローン化されたコリネバクテリア挿入配列を遺伝子プローブとして用いることも行われています。
シック試験は長年にわたりジフテリア毒素に対する免疫を評価するために使用されてきましたが、現在では多くの地域でジフテリア毒素に対する特異抗体の血清学的検査に取って代わられています。シック試験では、少量のジフテリア毒素(0.2 ml中約0.8 ng)を前腕(試験部位)に皮内注射し、対照部位には0.2 ml中0.0124 μgのジフテリア毒素を皮内注射します。48時間後と96時間後に測定値を取得します。非特異的皮膚反応は通常48時間後にピークに達します。96時間後に試験部位に紅斑反応が見られ、壊死の可能性もある場合は、毒素を中和するのに十分な抗毒素免疫がないことを示します(0.03 IU/ml以下)。 48 時間後にテスト領域とコントロール領域の両方で炎症が見られた場合、抗原調製物に対する過敏症反応を示しています。
フォーム
ジフテリア菌は鼻咽頭または皮膚に感染します。毒素産生株は強力な外毒素を産生し、ジフテリアを引き起こします。ジフテリアの症状には、咽頭炎、発熱、頸部または皮膚病変周辺の腫れなどがあります。ジフテリア病変は偽膜で覆われます。毒素は血流を介して遠隔臓器に広がり、麻痺やうっ血性心不全を引き起こす可能性があります。[ 6 ]
臨床ジフテリアには、鼻咽頭型と皮膚型の2種類があります。咽頭型ジフテリアの症状は、軽度の咽頭炎から、偽膜による気道閉塞に起因する低酸素症まで多岐にわたります。頸部リンパ節への感染により、重度の頸部腫脹(牛頸ジフテリア)が起こり、発熱(103°F以上)を呈することもあります。皮膚型ジフテリアの皮膚病変は通常、灰褐色の偽膜で覆われます。ジフテリア毒素が末梢運動ニューロンと心筋に作用することで、主に運動機能の喪失(嚥下困難など)やうっ血性心不全といった、生命を脅かす全身性合併症が発生することがあります。
コントロール
ジフテリアの制御は、ジフテリアトキソイドによる適切な予防接種にかかっています。ジフテリアトキソイドは、ジフテリア毒素をホルムアルデヒドで不活化したもの(抗原性はそのまま)です。このトキソイドは、アルカリ性条件下でジフテリア毒素をホルムアルデヒドと 37°C で培養して調製します。ジフテリアの予防接種は、生後 2 か月目に開始し、4 ~ 8 週間間隔で 3 回の初回接種を行い、最後の初回接種から約 1 年後に 4 回目の接種を行います。ジフテリアトキソイドは、ジフテリア・百日咳・破傷風 (DPT) ワクチンの成分として広く使用されています。疫学研究では、ジフテリアに対する予防接種の有効性が約 97 % であることが示されています。米国および欧州ではジフテリアの集団予防接種が実施されており、小児の予防接種率も適切ですが、成人の大部分は抗体価が防御レベルを下回っている可能性があります。成人は10年ごとにジフテリアトキソイドの再接種を受ける必要があります。特に、ジフテリアの風土病発生率が高い地域(中南米、アフリカ、アジア、ロシア、東ヨーロッパ)への旅行者は、ジフテリア・破傷風トキソイドによる追加接種を受ける必要があります。近年、高度に精製されたトキソイド製剤が予防接種に使用されていることで、重度の過敏症反応が時折発生する可能性が最小限に抑えられています。ジフテリアの風土病発生率が高い地域(中南米、アフリカ、アジア、ロシア、東ヨーロッパ)への旅行者は、ジフテリア・破傷風トキソイドによる追加接種を受ける必要があります。近年、高度に精製されたトキソイド製剤が予防接種に使用されていることで、重度の過敏症反応が時折発生する可能性が最小限に抑えられています。ジフテリアの流行率が高い地域(中南米、アフリカ、アジア、ロシア、東ヨーロッパ)への旅行者は、ジフテリア・破傷風トキソイドによる追加免疫を受ける必要があります。近年では、高度に精製されたトキソイド製剤を予防接種に使用することで、稀に起こる重度の過敏症反応を最小限に抑えています。
ジフテリア患者の治療にはペニシリンやエリスロマイシンなどの抗生物質が使用されますが、ジフテリア抗毒素による迅速な受動免疫が致死率の低減に最も効果的です。特異的抗毒素の血中半減期が長いことは、ジフテリア毒素を効果的に中和する上で重要な要素ですが、効果を発揮するには、抗毒素が毒素が細胞内に侵入する前に反応する必要があります。
真核生物受容体特異的細胞毒素の開発に向けたジフテリア毒素の再設計
タンパク質工学は、分子生物学における新たな分野であり、急速に発展しています。組換えDNA法と固相DNA合成法を組み合わせ、独自の特性を持つキメラ遺伝子を設計・構築します。ジフテリア毒素の構造と機能の関係に関する研究により、この毒素は触媒ドメイン、膜貫通ドメイン、受容体ドメインの3つのドメインタンパク質であることが明確に示されています。ジフテリア毒素の本来の受容体結合ドメインを、様々なポリペプチドホルモンやサイトカイン(例えば、α-メラノサイト刺激ホルモン[α-MSH]、インターロイキン-2、IL-4、IL-6、IL-7、上皮成長因子)に遺伝子置換することが可能です。得られたキメラタンパク質、すなわち融合毒素は、サイトカインの受容体結合特異性と毒素の膜貫通ドメインおよび触媒ドメインを融合したものです。いずれの場合も、融合毒素は、対応する標的受容体を持つ細胞のみを選択的に毒性を発揮することが示されています。これらの遺伝子組み換え融合毒素の最初のものであるDAB 389IL-2は現在、高親和性IL-2受容体を有する細胞が病態形成において重要な役割を果たす難治性リンパ腫および自己免疫疾患の治療薬として、ヒト臨床試験で評価されています。[ 7 ] DAB 389 IL-2の投与は安全で忍容性が高く、重篤な副作用なく持続的な疾患寛解を誘導できることが示されています。ジフテリア毒素をベースとした融合毒素は、特定の細胞表面受容体を標的とする特定の腫瘍や疾患の治療において、重要な新規生物学的製剤となる可能性があります。



 [
[